Tính chất và công dụng của Silicon Dioxide (SiO2) chi tiết nhất
29 Tháng Mười Một, 2021Contents Silicon Dioxide là gì? SiO2 là một oxit silicon có tên hóa học Silicon Dioxide. Nó cũng được gọi...
Contents
Axit nitric là một axit mạnh với công thức hóa học HNO3. Nó còn được gọi là tinh thần của niter và aqua fortis. Ở dạng tinh khiết, nó không màu nhưng khi nó già đi, nó biến thành một diễn viên màu vàng. Màu này xuất hiện do sự phân hủy axit Nitric thành oxit nitơ và nước. Nó có tính ăn mòn cao và độc hại. Nó gây bỏng da nghiêm trọng. Nó phản ứng với hydroxit, kim loại và oxit để tạo thành muối nitrat.
HNO3 được sử dụng như một tác nhân oxy hóa mạnh. Nó có thể được sản xuất bởi quá trình oxy hóa xúc tác của amoniac. Nó là một loại thuốc thử phổ biến được sử dụng trong các phòng thí nghiệm và là một hóa chất quan trọng được sử dụng trong các ngành công nghiệp để sản xuất chất nổ và phân bón. PH của axit Nitric là khoảng 3,01.
Các phân tử axit nitric chứa 3 nguyên tử oxy, 1 nguyên tử nitơ và 1 nguyên tử hydro. Trong các phân tử HNO3, một trong những nguyên tử oxy được liên kết gấp đôi với nguyên tử nitơ trung tâm. Một nguyên tử oxy khác được liên kết đơn lẻ với nguyên tử nitơ trung tâm và cũng liên kết đơn lẻ với một nguyên tử hydro. Nguyên tử oxy cuối cùng trong phân tử axit nitric có điện tích -1 và được liên kết đơn lẻ với nguyên tử nitơ trung tâm. Vì nguyên tử nitơ ở trung tâm của phân tử đang tham gia vào bốn liên kết cộng hóa trị (với 3 nguyên tử oxy), nó có điện tích +1. Do đó, điện tích ròng trên phân tử axit nitric là 0 (điện tích dương trên nguyên tử nitơ và điện tích âm trên nguyên tử oxy hủy bỏ lẫn nhau). Có thể lưu ý rằng các điện tích trong các phân tử này có thể được khử vị thế do cộng hưởng. Cấu trúc của các phân tử axit nitric được minh họa dưới đây.
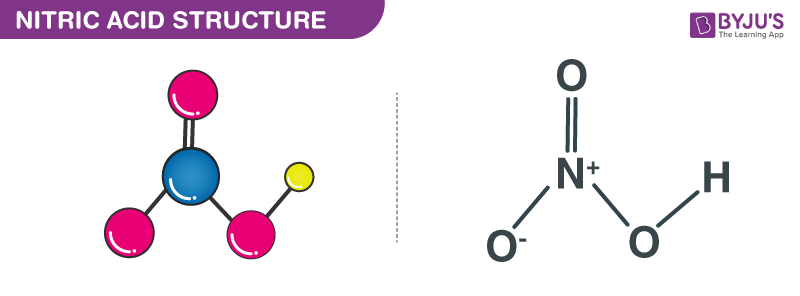

Cấu trúc của Axit Nitric
Một axit dễ bay hơi hơn có thể được thay thế từ muối của nó bởi một axit ít bay hơi hơn. Đây là nguyên tắc cơ bản trong việc chuẩn bị axit nitric trong phòng thí nghiệm.
Axit nitric là một axit dễ bay hơi hơn axit sulphuric được thay thế bởi axit sulphuric từ nitrat kim loại.
50gm kali nitrat (KNO)3) + 25ml axit sulphuric đậm đặc (H2như vậy4) được lấy trong một bình đáy tròn. Các chất phản ứng được làm nóng đến khoảng 200oC chăm sóc rằng nhiệt độ không vượt quá 200OC.
Phản ứng
KNO3 + H2như vậy4 → KHSO4 + HNO3
(Muối của axit dễ bay hơi hơn + axit ít bay hơi → thay thế axit dễ bay hơi hơn)


Chuẩn bị phòng thí nghiệm axit Nitric – HNO3
Hơi của axit nitric được làm mát và ngưng tụ để thu thập như trong sơ đồ.
| HNO3 | Axit Nitric |
| Trọng lượng phân tử / Khối lượng mol | 63,01 g/mol |
| mật độ | 1,51 g / cm³ |
| Điểm sôi | 83 °C |
| Điểm nóng chảy | -42 °C |
Axit nitric là một chất lỏng không màu đến vàng với mùi mạnh, sốc, có tính axit. Axit nitric đậm đặc phát ra khí nitơ dioxide và nitơ oxit 85-100 phần trăm).
Axit nitric là một axit có đặc tính axit. Các tính chất như vậy bao gồm độ pH dưới 7, vị đắng và đôi khi là phản ứng dữ dội với các kim loại khác. Công thức hóa học cho axit nitric là HNO3. Axit nitric là một chất lỏng màu trắng, rất ăn mòn, không màu.
H2 hoạt động như một cơ sở để trừu tượng hóa H từ axit nitric. Kết quả H+3O, hydronium, là axit liên hợp, trong khi ba điểm của liên hợp là NO+3–, nitrat (đây là phân tử axit nitric, nhưng H của nó được loại bỏ.+
Một số kim loại và hợp kim bị oxy hóa bởi axit nitric; tuy nhiên, khi bị axit nitric đậm đặc tấn công, vàng và bạch kim không bị oxy hóa và một số kim loại nhất định được thụ động. Bằng cách sử dụng hỗn hợp axit hoặc dung dịch nitric loãng, các kim loại này có thể được hòa tan.
Trung hòa axit natri bicarbonate nitric. … Nếu điều này là chính xác, trung hòa một phần axit nitric đòi hỏi một phần natri bicarbonate. Có lẽ 5 phần trăm nitric không nặng hơn nhiều so với nước, vì vậy 100 gallon dung dịch bằng 834 pound axit nitric bằng 42 pounds.
Xem thêm: