Tính chất và công dụng của Glycerin (C3H8O3) chi tiết nhất
29 Tháng Mười Một, 2021Contents Glycerin là gì? Glycerin là một hợp chất poly đơn giản. Dung môi này có công thức hóa...
Contents
OH− là một anion giải cứu với tên hóa học Hydroxit.
Hydroxit còn được gọi là hydroxyl hoặc hydroxyl gốc hoặc hydroxoxide ion. Nó bao gồm một hydro và một nguyên tử oxy được giữ lại với nhau bởi một liên kết cộng hóa trị. Hydro mang điện tích âm. Nó được sử dụng rộng rãi như một chất bảo quản thực phẩm, để kiềm hóa nước tiểu để ngăn ngừa sỏi thận, một chất chống đông máu được lưu trữ và đệm. Nó hoạt động như một phối tử, chất xúc tác, một cơ sở và một nucleophile.
Ion tạo thành các muối trong đó một số trong số chúng phân tán trong dung dịch nước để giải phóng các ion hydroxit giải quyết. Nó là một thành phần nhỏ của nước. Khi một trung tâm điện cực mạnh và hydroxit được gắn vào nhau, hydroxit có thể ion hóa để giải phóng một cation hydro và tạo ra hợp chất mẹ như một axit.
Hồ• đó là hợp chất trung tính điện là gốc hydroxyl. –OH là nhóm liên kết cộng hóa trị là nhóm hydroxy. Nhóm hydroxy và ion hydroxit là các hạt nhân và hoạt động như chất xúc tác trong hóa học hữu cơ.
| Hydroxit | ồ− |
| Trọng lượng phân tử của Hydroxit | 17,007 g/mol |
| Khối lượng đơn vị của Hydroxit | 17,003 g/mol |
| Cơ sở liên hợp | Anion oxit |
| Axit liên hợp | Nước |
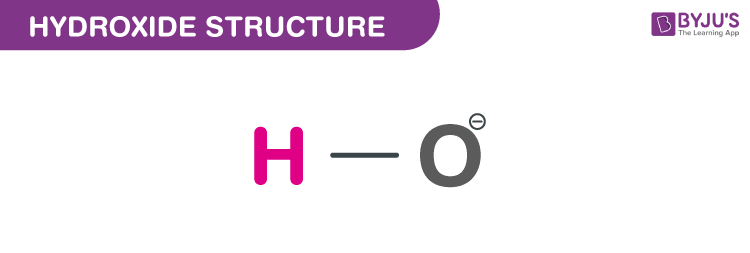

Cấu trúc của Hydroxit
Tất cả các chất vô cơ có từ hydroxit trong tên của chúng không có nghĩa là các hợp chất ion của ion hydroxit. Chúng là các hợp chất cộng hóa trị có chứa các nhóm hydroxy.
Nếu một trong những ion đó là H+, dung dịch có tính axit. Hydro clorua axit mạnh (HCl) là một ví dụ. Nếu một trong các ion là OH-, thì giải pháp là cơ bản. Natri hydroxit (NaOH) là một ví dụ như vậy về một ba cơ sở rắn.
Khi độ pH của dung dịch nhỏ hơn 7, dung dịch được coi là có tính axit; nếu pH khoảng 7, dung dịch là trung tính; nếu pH lớn hơn 7, dung dịch được coi là cơ bản. Đối với dung dịch axit, sau đó, nồng độ ion hydro cao hơn nồng độ ion hydroxit.
Hydroxit xảy ra một mình khi ở trong nước, vì axit và bazơ có thể trung hòa lẫn nhau trong dung dịch, và điều rất quan trọng trong tình huống này là phân biệt giữa HO và H2O trong các phản ứng.
Bê tông bị ăn mòn, và các giải pháp của nó là. Natri hydroxit không mùi; do đó, mùi không phản ứng với nồng độ nguy hiểm. Natri hydroxit không tạo ra độc tính toàn thân nhưng nó rất ăn mòn và có thể gây bỏng cực độ trong tất cả các mô mà nó tiếp xúc.
Trong hợp chất này, hai electron chia sẻ liên kết oxy với hydro. Hydroxit mang điện tích âm, vì một electron đã được hấp thụ. Oxy, được mô tả là O, bị ràng buộc với hydro, được mô tả là H, vì vậy chúng ta có thể thấy rằng dấu hiệu âm là thành phần tiêu cực nhất của sản phẩm.
Xem thêm:
Độ chính xác là gì? Xem xong 5 phút hiểu luôn.
Dân số và Mẫu là gì? Xem xong 5 phút hiểu luôn.
Ký hiệu xác suất và thống kê là gì? Xem xong 5 phút hiểu luôn.