Bạc Nitrat (AgNO3) Đọc dễ hiểu nhất
2 Tháng Mười Hai, 2021Contents Silver Nitrat là gì? Bạc nitrat là một hợp chất hóa học có công thức AgNO3. Nó bao...
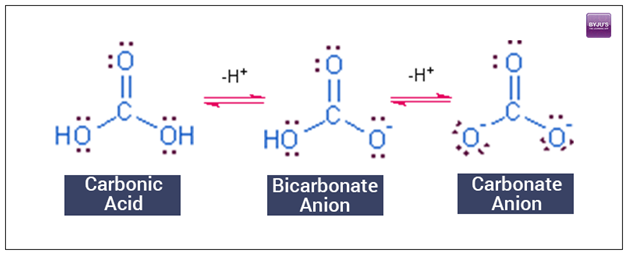
Theo các văn bản trong sách hóa học vô cơ, bicarbonates là dạng trung gian trong quá trình khử cacbonic. Nó là một anion đa nguyên tử với HCO3– như công thức hóa học của nó. Bicarbonates phục vụ một vai trò sinh hóa thiết yếu trong các hệ thống dựa trên đệm pH sinh lý.
Contents

Sự cân bằng của thành phần axit-bay trong duy trì và kiểm soát bởi khả năng của hệ hô hấp để loại bỏ carbon dioxide dư thừa cùng với khả năng của thận để loại bỏ chất thải trong nước tiểu và hệ thống đệm được gọi là hệ thống đệm của bicarbonates. Sự sẵn có thích hợp của bicarbonates là yếu tố hạn chế lớn nhất để trung hòa chất thải axit trong cơ thể con người, phục vụ như một chất chống oxy hóa. Bicarbonates cũng có thể được cung cấp qua nước, trên thực tế, cả nước và máu đều không khỏe mạnh nếu không có chúng.
Trung hòa axit dựa trên sự tồn tại của bộ đệm. Ví dụ, nếu một axit yếu được thêm vào một ly nước có dung tích đệm bằng không, pH sẽ giảm ngay lập tức. Nhưng, nếu cùng một lượng axit được thêm vào một ly chứa đầy nước đệm, pH vẫn giữ nguyên như trước đây. Bộ đệm trung hòa axit và để lại độ pH của dung dịch giống nhau. Các bộ đệm thường là bicarbonates trong nước và trong cơ thể con người.
Các hệ thống đệm bicarbonates bao gồm axit yếu tức là axit cacbonic (H)2Đồng3) và một cơ sở yếu tức là bicarbonate (HCO3). Khi kết hợp, chúng có chức năng giữ độ pH của máu và các chất lỏng bên trong khác trong một phạm vi cụ thể. Axit cacbonic trong dung dịch phân ly thành các ion hydro và ion bicarbonate. Khi axit được thêm vào hệ thống bicarbonate, các ion bicarbonate kết nối lại với các ion H và tạo thành axit carbonic một lần nữa. Điều này làm giảm nồng độ ion H và đưa pH trở lại giá trị ban đầu của nó. Các bộ đệm trung hòa axit bằng cách loại bỏ các ion hydro.++
Bicarbonates cung cấp cho máu khả năng chống lại những thay đổi trong pH. Bất kỳ biến thể phút nào trong độ pH của máu có thể phá vỡ các chức năng trao đổi chất quan trọng. Bicarbonates cũng góp phần chống lại tác động của mưa axit trong nước tự nhiên và các ảnh hưởng axit khác. Sự dao động mạnh mẽ trong độ pH của suối và sông có thể phá hủy như nhau. Đại dương cũng được đệm bằng bicarbonates và có khả năng trung hòa lượng chất thải axit khổng lồ.
Có nhiều bicarbonate hơn so với axit carbonic (tỷ lệ xấp xỉ 20:1) trong điều kiện lý tưởng trong cơ thể con người. Điều này phù hợp cho các sinh vật giải phóng chất thải trao đổi chất. Nồng độ bicarbonate cao hơn ở trạng thái cân bằng có khả năng trung hòa lượng axit đáng kể. Tuy nhiên, bicarbonates trở thành yếu tố hạn chế dưới áp lực. Ô nhiễm, chế độ ăn uống, tập thể dục và tuổi tác vẽ bicarbonates và hạn chế khả năng trung hòa và tiêu diệt axit của cơ thể.