Tính chất và công dụng của Phenol (C6H6O) chi tiết nhất
29 Tháng Mười Một, 2021Contents Phenol là gì? Phenol là một hợp chất thơm. Công thức hóa học của hợp chất hữu cơ...
Contents
MgSO4 là một loại muối vô cơ có tên hóa học là Magiê sunfat. Nó còn được gọi là muối magiê axit sulfuric hoặc magiê sunfat khan. Nó thường được gọi là muối Epsom. Magiê sunfat là một chất rắn tinh thể có hình dạng màu trắng và không mùi. Nó chủ yếu được sử dụng như một bồn tắm ngâm để loại bỏ các cơ đau, để giảm bớt cơn đau bong gân và vết bầm tím, v.v. Nó cũng giúp loại bỏ các mảnh vụn và khá hiệu quả.
| MgSO4 | Magiê sunfat |
| Trọng lượng phân tử / Khối lượng mol | 120,366 g/mol |
| mật độ | Khan: 2,66 g/cm3 |
| vị | Vị đắng, nước muối |
| Điểm nóng chảy | 1.124 °C |
Điều quan trọng cần lưu ý là magiê sunfat khan trải qua quá trình phân hủy ở nhiệt độ trên 1124 độ C. Vì MgSO4 là một muối ion, nó thể hiện độ hòa tan cao trong nước. Cũng có thể lưu ý rằng độ hòa tan của magiê sunfat trong nước tăng lên khi nhiệt độ tăng lên. Ví dụ, độ hòa tan của MgSO4 khan trong nước ở nhiệt độ 0 oC là269 gram mỗi lít. Khi nhiệt độ tăng lên 100 oC, độ hòa tan của muối ion này trong nước gần gấp đôi lên 502 gram mỗi lít.
Magiê sunfat được biết đến là thành phần của nhiều muối kép (muối ion chứa nhiều hơn một cation hoặc nhiều hơn một anion). Các muối kép thường được biết đến có chứa MgSO4 bao gồm kali magiê sunfat và natri magiê sunfat. Trong điều kiện tiêu chuẩn cho nhiệt độ và áp suất (STP), MgSO4 tồn tại dưới dạng chất rắn tinh thể màu trắng không có bất kỳ mùi đặc trưng nào.
Cấu trúc của một phân tử magiê sunfat được minh họa dưới đây. Lưu ý rằng MgSO4 phân tử chứa một Mg2+ cation (ion magiê) và một SO42- anion (anion sunfat).
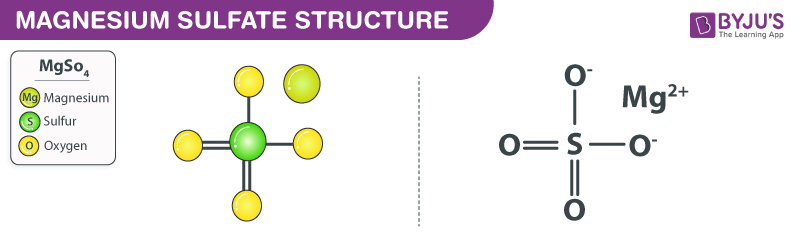

Một liên kết ion được hình thành giữa cation magiê và anion sunfat trong magiê sunfat. Trong anion sunfat, tồn tại hai liên kết đôi lưu huỳnh-oxy và hai liên kết đơn lưu huỳnh-oxy. Các nguyên tử oxy được liên kết đơn lẻ với nguyên tử lưu huỳnh mỗi nguyên tử giữ một điện tích âm có cường độ -1. Do đó, tổng điện tích trên anion sunfat là -2. Điện tích trên cation magiê có cường độ +2. Do đó, các điện tích dương và âm trong hợp chất ion này hủy bỏ lẫn nhau, dẫn đến một phân tử magiê sunfat tích điện trung tính. Tuy nhiên, khi hợp chất này được hòa tan trong nước và các dung môi cực khác, magiê và các ion sunfat phân tán.
Một trong những ứng dụng quan trọng nhất của magiê sunfat là trong việc chuẩn bị magiê tĩnh mạch, một loại thuốc quan trọng để điều trị chứng sản giật. Nó cũng được sử dụng trong các liệu pháp thay thế để điều trị thiếu magiê. Cũng có thể lưu ý rằng magiê sunfat có thể được sử dụng như một tác nhân đông máu để chuẩn bị một số mặt hàng thực phẩm như đậu phụ.
Hợp chất này rất nguy hiểm khi được sử dụng với liều cao hơn được bác sĩ khuyên dùng hoặc hướng dẫn trên bao bì. Một liều lượng cao của hợp chất này gây ra tác dụng phụ nghiêm trọng và cũng có thể đe dọa tính mạng. Nồng độ magiê cao bất thường trong huyết tương có thể dẫn đến một tình trạng y tế được gọi là tăngmagnesemia.
1. Magiê sunfat có phải là hợp chất hay hỗn hợp không?
Ans: Magiê sunfat, MgSO4, là một chất kết tinh không màu được hình thành bởi sulphur dioxide và phản ứng không khí của magiê hydroxit.
2. Magiê sunfat có hòa tan trong rượu không?
Ans: Magiê sulfate heptahydrate là một tinh thể màu trắng, kết tinh hoặc rực rỡ, thường giống như kim. Nó dễ hòa tan trong nước, trong nước sôi dễ hòa tan hơn và trong rượu hầu như không hòa tan.
3. Công thức dưỡng ẩm cho MgSO4 là gì?
Ans: Để có được tỷ lệ nốt ruồi, chia nốt ruồi của nước bằng nốt ruồi khan. 5 nốt ruồi MgSO4 nốt ruồi H2O/1 nốt ruồi = 5:1. Để viết phương trình, hãy sử dụng tỷ lệ nốt ruồi. Bởi vì cứ mỗi 1 mol MgSO4 có 5 nốt ruồi của H2O, công thức là 5H2O MgSO4.
4. Magiê sulfate heptahydrate được sử dụng để làm gì?
Ans: Một trong những ứng dụng chính của magiê sunfat là được sử dụng làm phân bón trong canh tác và làm vườn. Đối với muối tắm, magiê sunfat được sử dụng.
5. Nốt ruồi được tính toán như thế nào?
Ans: Sử dụng công thức phân tử để tính khối lượng mol; chia trọng lượng của hợp chất cho khối lượng mol của hợp chất được đo bằng gam để có được số lượng nốt ruồi.