Tính chất và công dụng của Axit tannic (C76H52O46) chi tiết nhất
18 Tháng Mười Một, 2021Contents Axit Tannic là gì? Axit tannic là một loại polyphenol và còn được gọi là Acidum tannicum hoặc...
Contents
Hydrogen peroxide là loại peroxide đơn giản nhất hiện có (liên kết đơn oxy-oxy). Nó là một chất lỏng không màu và được sử dụng trong dung dịch nước vì lý do an toàn. Nó hoạt động như một chất tẩy trắng và cũng được sử dụng như một chất khử trùng. Hydro peroxide đậm đặc là một loài oxy rất phản ứng và được sử dụng làm chất đẩy trong tên lửa. Công thức hóa học cho hydro peroxide là H2O2.
Nó thường được gọi là nước có thêm một nguyên tử oxy. Nó có tính axit trong tự nhiên và PH là khoảng 4,5. Nó là hợp chất phân hủy 100%.
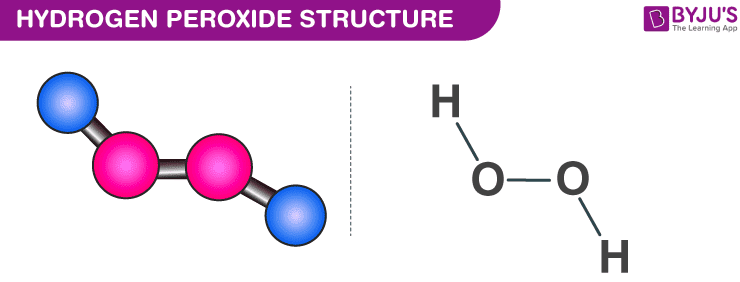

| Hydrogen peroxide Công thức hóa học | H2O2 |
| Trọng lượng phân tử / Khối lượng mol | 4,0147 g/mol |
| mật độ | 1,05 g / cm3 |
| Điểm sôi | 150,2 °C |
| Điểm nóng chảy | -0,43 °C |
Cấu trúc của hydro peroxide là phi planar. H2O2 có cấu trúc sách mở với vòng quay O – O. Góc dihedral là 111 °. Chiều dài trái phiếu O-O là 145,8 pm và chiều dài trái phiếu O-H là 98,8 pm (bằng 9,88 × 10-13 m). Sơ đồ sau đây sẽ cho thấy rõ ý nghĩa của cấu trúc sách mở.
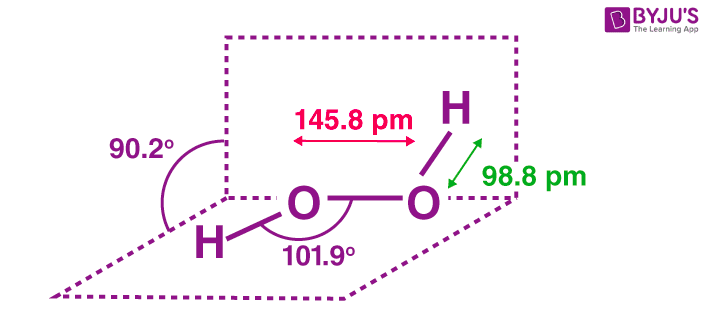

Cấu trúc Hydrogen Peroxide
Có hai mặt phẳng trong cấu trúc này và mỗi mặt phẳng có một cặp liên kết O-H, góc giữa cả hai mặt phẳng là 90,2 °.
Chúng ta hãy xem xét các phương pháp chuẩn bị khác nhau cho hydro peroxide.
Khi bari peroxide được axit hóa và nước dư thừa được loại bỏ bằng quá trình bay hơi dưới áp suất giảm, chúng tôi thu được hydro peroxide. Phản ứng sau đây sẽ làm rõ điều này:
Bảo2.8H2O (s) + H2như vậy4(aq) → BaSO4(s) + H2O2(aq) + 8H2O(l)
Hydrogen peroxide được điều chế bằng điện phân 30% ice-cold H2SO4. Khi dung dịch sunfat axit hóa được điện phân ở mật độ dòng điện cao, thu được peroxodisulphate. Peroxodisulphate sau đó được thủy phân để có được hydro peroxide.
2HSO–4(aq) [Điện phân] → HO3SOOSO3H(aq) [Thủy phân] → 2HSO–4(aq)+2H+(aq)+H2O2(aq)
2H2như vậy4 → 2H+ 2HSO+ –4
Tại Cathode: 2H+ 2e+ – → H2
Tại Anode:
2HSO–4 → H2S2O8 + 2e– ⇒ axit sulphuric Peroxodi [axit Marshall]
H2S2O8 + H2O → H2như vậy5 + H2như vậy4 ⇒ axit sulphuric Peroxomono [axit caro]
H2như vậy5 + H2O → H2như vậy4 + H2O2

Phương pháp chuẩn bị tự động oxy hóa H2O2
Hydrogen peroxide trong cả môi trường axit và cơ bản hoạt động như một chất oxy hóa cũng như một tác nhân khử. Các phản ứng sau đây sẽ đưa ra một bức tranh rõ ràng:
⇒: Phản ứng oxy hóa khử
Nó tẩy trắng bằng quá trình oxy hóa. H2O2 tẩy trắng lụa, len, bông, tóc.
Phản ứng: H2O2 → H2O + [O] Oxy non
Chất màu + [O] → màu
Hydrogen peroxide phân hủy khi tiếp xúc với ánh sáng mặt trời, quá trình này được xúc tác bởi dấu vết của kim loại kiềm. Do đó, H2O2 được lưu trữ trong các hộp thủy tinh hoặc nhựa lót sáp và được giữ trong bóng tối.
Nó cũng nên được tránh xa các hạt bụi vì bụi có thể gây ra sự phân hủy nổ của hợp chất này.
Xem thêm:
Độ chính xác là gì? Xem xong 5 phút hiểu luôn.
Dân số và Mẫu là gì? Xem xong 5 phút hiểu luôn.
Ký hiệu xác suất và thống kê là gì? Xem xong 5 phút hiểu luôn.