Tính chất và công dụng của Methyl axetat (C3H6O2) chi tiết nhất
18 Tháng Mười Một, 2021Contents Methyl axetat là gì? C3H6O2 là một este carboxylate với tên hóa học Methyl acetat. Nó còn được gọi...
Contents
Zn(NO3)2 là một hợp chất hóa học vô cơ với tên hóa học Kẽm nitrat. Nó còn được gọi là Kẽm dinitrate hoặc Celloxan hoặc Kẽm Nitrate Hexahydrate. Nó được sử dụng rộng rãi như một chất xúc tác để sản xuất trong y học, thuốc nhuộm và các hóa chất khác.
Celloxan là một chất rắn từ trắng đến không màu, kết tinh rất tinh tế. Nó hòa tan trong rượu cũng như nước. Nó là một hợp chất không cháy nhưng có khả năng đẩy nhanh quá trình đốt cháy các hợp chất dễ cháy khác. Các oxit độc hại của nitơ được giải phóng khi đun nóng.
| Zn(NO3)2 | Kẽm nitrat |
| Trọng lượng phân tử của Zn (KHÔNG3)2 | 189,36 g/mol (khan) |
| Mật độ kẽm nitrat | 2,065 g/ cm3 (khan) |
| Điểm nóng chảy của kẽm nitrat | 110 °C |
| Điểm sôi kẽm nitrat | Xấp xỉ 125 °C |
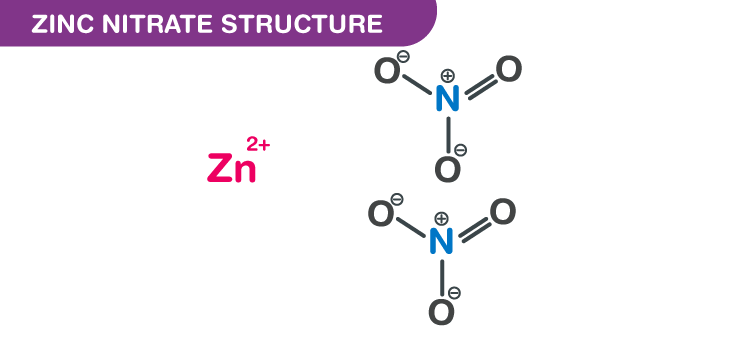

Nó được sản xuất bằng cách hòa tan kẽm trong axit nitric. Phản ứng phụ thuộc vào nồng độ, và tạo thành amoni nitrat. Phản ứng được đưa ra dưới đây:
Zn + 2 HNO3 (pha loãng) → Zn(KHÔNG3)2 + H2
4 Zn + 10 HNO3 (tập trung) → 4 Zn (KHÔNG3)2 + NH4Không3 + 3 H2O
Nó trải qua quá trình phân hủy nhiệt khi sưởi ấm và tạo thành oxit kẽm, oxy và nitơ dioxide.
2 Zn (KHÔNG)3)2 → 2 ZnO + 4 KHÔNG2 + O2
Hít phải bụi gây kích ứng ở cổ họng và mũi. Nuốt kẽm dinitrate có thể dẫn đến ăn mòn đường tiêu hóa. Tiếp xúc với da dẫn đến kích ứng và có thể gây phát ban.
Khi đun nóng, nó có thể giải phóng các oxit độc hại của nitơ. Khi tiếp xúc với vật liệu dễ cháy, nó có thể làm tăng cường độ cháy.
Kẽm nitrat không có sử dụng quy mô rộng, nhưng được sử dụng để tổng hợp các polyme phối hợp trên quy mô phòng thí nghiệm. Sự phân hủy được kiểm soát đối với oxit kẽm cũng có thể được sử dụng để tạo ra các cấu trúc khác nhau, bao gồm cả dây nano. Nó cũng có thể được sử dụng như một chất nhuộm.
Các anion hydroxit đến từ nước có thể giải phóng các anion nitrat khi kẽm nitrat được đưa vào dung dịch nước. HNO3 trông không giống một phân tử, hãy nhớ đến bạn! Phản ứng dẫn đến sự hình thành các ion hydronium , đó là lý do tại sao dung dịch có thể được coi là có tính axit.
Nhôm và kẽm không phản ứng với axit nitric đậm đặc do sự hình thành một lớp oxy hóa dày đặc, khó hòa tan do một quá trình được gọi là quá trình oxy hóa thụ động. Điều này bảo vệ kim loại chống lại phản ứng và ăn mòn hơn nữa. Tuy nhiên, kẽm phản ứng với axit nitric loãng.
Xem thêm:
Quan hệ phản xạ là gì? Xem xong 5 phút hiểu luôn.
Tỷ lệ và Tỷ lệ là gì? Xem xong 5 phút hiểu luôn.
Số hợp lý trên một dòng số là gì? Xem xong 5 phút hiểu luôn.