Tính chất và công dụng của Natri Bromua (NaBr) chi tiết nhất
13 Tháng Bảy, 2021Contents Natri Bromide là gì? Natri bromide là một hợp chất vô cơ ở dạng khô, một loại bột kết tinh...
Contents
MgCO3 là một loại muối vô cơ có tên hóa học Là Magiê Cacbonat. Nó cũng được gọi là Magnesit hoặc Hydromagnesite hoặc Barringtonite.Các dạng magnesit ngậm nước như di, tri, tetrahydrat có mặt dưới dạng khoáng vật. Nó hoạt động như một loại phân bón và như một thuốc kháng axit. Nó được sử dụng rộng rãi trong sản xuất các vật liệu có khả năng chịu được nhiệt độ cực cao.
Magiê cacbonat là một magiê cacbonat ngậm nước cơ bản hoặc một magiê cacbonat thường ngậm nước. Nó xảy ra dưới dạng khối lượng nhẹ, trắng, dễ chiên hoặc như một loại bột màu trắng cồng kềnh. Nó không mùi và ổn định trong không khí. Nó thực tế không hòa tan trong nước mà tuy nhiên nó truyền đạt một phản ứng hơi kiềm. Nó không hòa tan trong rượu nhưng được hòa tan bởi axit loãng với sủi bọt.
Hydromagnesit là một hợp chất màu trắng hoặc vàng hoặc xám trắng hoặc nâu thu được ở dạng bột tinh thể hoặc rắn tinh thể. Nó là một quặng quan trọng cho magiê. Nó là một muối cacbonat, một hợpchất một carbonvà một muối magiê.
| MgCO3 | Magiê Cacbonat |
| Trọng lượng phân tử của MgCO3 | 84,3139 g/mol (khan) |
| Mật độ magiê cacbonat | 2,958 g/cm3 (khan) |
| Điểm nóng chảy của Magiê Cacbonat | 350 °C |
| Điểm sôi của Magiê Cacbonat | Phân hủy |
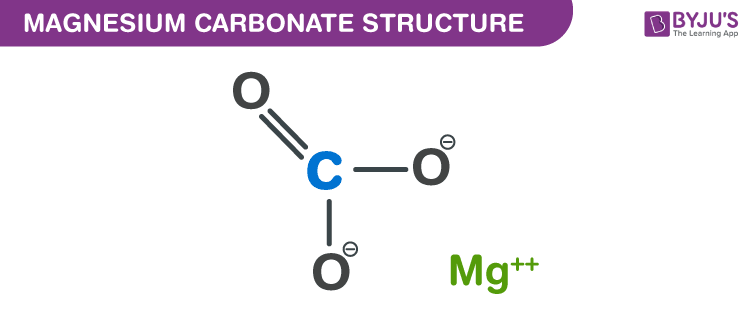

Cấu trúc của Magiê Cacbonat
Danh sách các công dụng của Magiê cacbonat được đưa ra dưới đây.
Magnesium carbonate is mainly used in processing magnesium oxide by calcining. Magnesite and dolomite minerals are used to make refractory bricks. MgCO3 is also used in fire extinguishing, flooring, cosmetics, dusting powder, fireproofing, and toothpaste.
Magnesium carbonate, a chemical compound with the formula MgCO3, is not toxic to human beings. This inorganic salt of magnesium is a white solid under ambient conditions.
Thông thường, magiê cacbonat là thông qua việc khai thác khoáng vật magnesit. Tại Trung Quốc, 70% nguồn cung trên toàn thế giới được khai thác và chuẩn bị. Trong phòng thí nghiệm, magiê cacbonat có thể được điều chế bằng phản ứng của bất kỳ muối magiê hòa tan và natri bicarbonate.
1. Nó có thể được điều chế trong phòng thí nghiệm bằng cách phản ứng với bất kỳ muối natri bicarbonate và magiê hòa tan nào. Phản ứng như sau:
MgCl2(aq) + 2NaHCO3(aq) → MgCO3(s) + 2NaCl(aq) + H2O(l) + CO2(g)
2. Nếu sunfat hoặc magiê clorua được xử lý bằng natri cacbonat nước, một phức hợp hydrat hóa của magiê cacbonat cũng như magiê hydroxit, một kết tủa của magiê cacbonat, được hình thành. Phản ứng như sau:
5MgCl2(aq) + 5Na2Đồng3(aq) + 5H2O(l) → Mg(OH)2·3MgCO3·3H2O(s) + Mg(HCO)3)2(aq) + 10NaCl(aq)
3. Về mặt công nghiệp, nó có thể thu được bằng cách kết hợp bùn magiê hydroxit và carbon dioxide ở nhiệt độ vừa phải và áp suất cao. Khi sấy chân không bicarbonate, nó mất carbon dioxide (CO2) và phân tử nước:
Mg(OH)2 + 2 CO2 → Mg (HCO)3)2
Mg (HCO)3)2 → MgCO3 + CO2 + H2O
1. Công dụng của magiê cacbonat là gì?
Ans: Magiê cacbonat được sử dụng để chống trầm cảm, để giảm huyết áp, để giúp ngăn ngừa chứng đau nửa đầu, để giảm kháng insulin và tăng hiệu suất tập thể dục,
2. Tác dụng phụ của magiê cacbonat là gì?
Ans: Tướng quân. Các triệu chứng độc tính magiê bao gồm hạ huyết áp, buồn nôn, nôn, đỏ bừng mặt, bí tiểu, hồi phục, lo lắng và thờ ơ, có thể dẫn đến yếu cơ, khó thở, hạ huyết áp nghiêm trọng, rối loạn nhịp tim và ngừng tim.
3. Điều gì xảy ra khi bạn làm nóng magiê cacbonat?
Ans: MgCO3, khi đun nóng đến nhiệt độ cao, phân hủy khi magiê cacbonat. Sau khi một mẫu carbonat không tinh khiết 20,29 g được phản ứng, 15,90 g vật liệu MgO mạnh không tinh khiết đã bị bỏ lại sau khi phân hủy.
4. Magiê cacbonat có giúp bạn ngủ không?
Ans: Nó giúp điều chỉnh chất lượng giấc ngủ và cả magiê hỗ trợ bạn đi ngủ, nhưng nó cũng giúp bạn có được giấc ngủ sâu sắc và yên bình.
5. Magiê cacbonat hydrat là gì?
Ans: Magiê Cacbonat Hydrate là một nguồn magiê không hòa tan trong nước có thể dễ dàng biến đổi bằng cách nung nóng (nung) sang các hợp chất magiê khác. Khi xử lý bằng axit pha loãng, các hợp chất cacbonat cũng giải phóng carbon dioxide.