Tính chất và công dụng của Kẽm axetat – Zn (CH3COO)2(H2O)2 chi tiết nhất
13 Tháng Bảy, 2021Contents Kẽm axetat là gì? Zn(CH3COO)2(H2O)2 là một muối axetat với tên hóa học kẽm axetat. Nó còn được gọi...
Contents
Natri cacbonat là một hợp chất hóa học vô cơ. Natri cacbonat là những gì thường được gọi là tro Soda. Tro soda được chiết xuất từ trona. Trona là một muối kép có chứa natri cacbonat và natri hydro cacbonat được hình thành do một loạt các quá trình bay hơi diễn ra tại các hồ.
Natri cacbonat thường được gọi là rửa soda hoặc tro soda là quan trọng nhất trong tất cả các hóa chất nặng cơ bản. Ưu điểm lớn của nó so với natri hydroxit là nó không ăn mòn và do đó, an toàn hơn để xử lý.
Natri cacbonat là muối diazonium của axit cacbonic với công thức hóa học Na2Đồng3. Nó còn được gọi là tinh thể Soda, tro soda, soda rửa. Hợp chất vô cơ này hòa tan trong nước và khi hòa tan trong nước, nó tạo thành axit carbonic và natri hydroxit. Ở dạng tinh khiết, nó là bột màu trắng và không mùi. Nó là một cơ sở mạnh mẽ và hoạt động như một thuốc kháng axit.
Natri cacbonat có thể được sản xuất bởi bốn quá trình – “Quá trình Solvay, quá trình Labnac, Quá trình kép, Quá trình điện phân”. Vì nó là một axit yếu, nó hơi hòa tan trong ethanol và không hòa tan trong rượu. Một trong những công dụng quan trọng của Na2Đồng3 là một chất làm mềm nước. pH là khoảng 11.
Natri cacbonat hiện được sản xuất độc quyền bởi quá trình Solvey. Trong quá trình này carbon dioxide và amoniac được truyền vào dung dịch natri clorua bão hòa lạnh. Trong các phản ứng xảy ra natri hydro cacbonat được hình thành chỉ hòa tan rất nhẹ với sự hiện diện của các ion natri, gần như kết tủa hoàn toàn. Nó được loại bỏ bằng cách lọc và đốt cháy để sản xuất natri cacbonat.
Các thành phần của quá trình này có sẵn và không tốn kém. Đó là nước muối (NaCl), amoniac (NH3) và đá vôi (CaCO3). Trong quá trình này, CaCl2 là một sản phẩm bổ trợ quan trọng thu được.
Các phản ứng có thể được biểu diễn bằng phương trình sau.
2NH3 + H2O + CO2 → (NH4)2CO3
(NH4)2CO3 + H2O + CO2 → 2NH4HCO3
Bổ sung muối thông thường vào dung dịch có chứa NH4+ và HCO3– dẫn đến lượng mưa của NaHCO3 ít hòa tan nhất. Sau đó, nó được lọc ra.
Nh4HCO3 + NaCl → NH4Cl + NaHCO3
Natri bicarbonate sau đó được làm nóng để cung cấp cho Na2Đồng3.
2NaHCO3 → Na2CO3 + CO2 + H2O
The CO2 khí phát triển có thể được tái sử dụng một lần nữa.
Natri cacbonat khan được hòa tan trong nước và kết tinh lại để có được tinh thể soda rửa có chứa 10 phân tử nước kết tinh.
| Na2Đồng3 | Natri Cacbonat |
| Trọng lượng phân tử / Khối lượng mol | 105,9888 g/mol |
| mật độ | 2,54 g / cm³ |
| Điểm sôi | 1.600 °C |
| Điểm nóng chảy | 851 °C |
1. Natri cacbonat khan ổn định theo hướng nhiệt. Nó tan chảy mà không bị phân hủy ở 852OC.
2. Dung dịch nước natri cacbonat có tính kiềm nhẹ do thủy phân giải phóng OH–(aq) ion.
Na2CO3(s) + 2H2O(l) → H2Đồng3(aq) + 2Na(aq) + 2OH+–(aq)
3. Dung dịch nước natri cacbonat hấp thụ carbon dioxide từ không khí tạo thành natri hydro cacbonat.
Na2Đồng3(aq) + H2O + CO2(g) → 2NaHCO3(aq)
4. Natri cacbonat phản ứng với các axit như axit thực vật yếu, chẳng hạn như nước cốt chanh giải phóng carbon dioxide.
Na2CO3(aq) + 2H(aq) → 2Na(aq) + H++2O(l) + CO2(g)
Na2CO3(aq) + 2HCl(aq) → 2NaCl(aq) + H2O(l) + CO2(g)
Cấu trúc của các phân tử natri cacbonat được minh họa dưới đây. Có thể lưu ý rằng mỗi phân tử natri cacbonat chứa 2 nguyên tử natri, 3 nguyên tử oxy và một nguyên tử carbon. Mỗi cation natri giữ một điện tích +1 trong khi anion cacbonat đa nguyên tử giữ điện tích ròng có cường độ -2. Do đó, natri cacbonat là một phân tử tích điện trung tính.
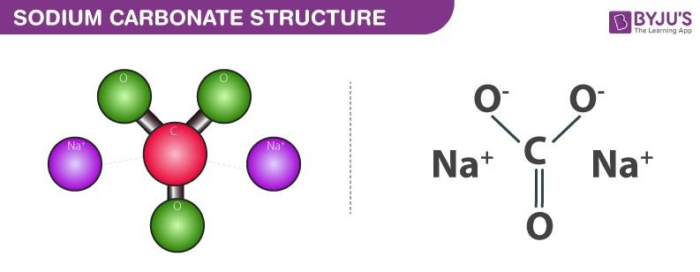

Việc sử dụng natri cacbonat được liệt kê dưới đây.
1. Tên gọi chung của natri cacbonat là gì?
Ans: Hợp chất vô cơ với công thức Na2Đồng3 là natri cacbonat, Na2Đồng3, còn được gọi là rửa soda, tro soda và tinh thể soda.
2. Đề cập đến các mối nguy hiểm của natri cacbonat?
Ans: Natri cacbonat có thể gây ra một số mối nguy hiểm về sức khỏe và an toàn. Việc hít phải hóa chất này có thể dẫn đến các tác dụng phụ như kích thích đường hô hấp, ho, khó thở và phù phổi.
3. Natri cacbonat khan là gì?
Ans: Natri cacbonat ngậm nước có công thức Na2C03.nH20. 0n nhiệt mạnh, natri cacbonat ngậm nước phân hủy hoàn toàn thành nước và natri cacbonat khan, Na2C03.
4. Natri cacbonat được sử dụng để làm gì?
Ans: Là chất làm mềm nước, hỗ trợ chế biến thực phẩm, sửa đổi pH, bể bơi hóa học và chất điện ly là những công dụng chính của natri cacbonat.
5. Natri cacbonat được tìm thấy ở đâu?
Ans: Nó được phát hiện trong các mỏ tự nhiên lớn và khai thác ở Wyoming; nó cũng được lấy từ nước rửa hồ ở California (với các hóa chất khác). Công dụng chính của natri cacbonat là sản xuất thủy tinh và sản xuất hóa chất.
Xem thêm: