Công thức tính diện tích hình tròn như thế nào?
23 Tháng Mười Hai, 2021Bạn đang tìm hiểu những thông tin liên quan đến công thức tính diện tích hình tròn, những câu...
Contents
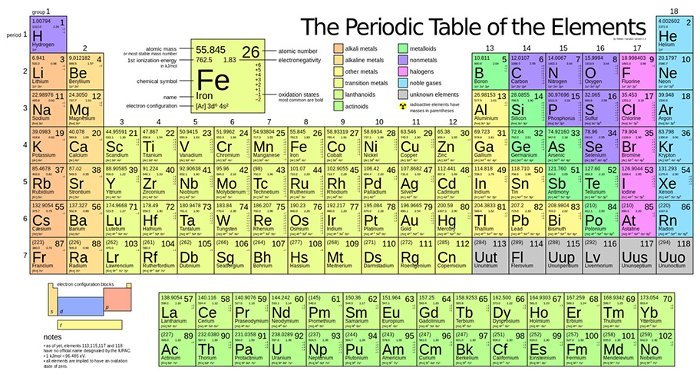

Bảng tuần hoàn chúng ta sử dụng ngày nay dựa trên bảng tuần hoàn do Dmitri Mendeleev phát minh và công bố vào năm 1869.
Mendeleev nhận thấy ông có thể sắp xếp 65 phần tử đã biết sau đó trong một lưới hoặc bảng sao cho mỗi phần tử có:
1. Một khối lượng nguyên tử lớn hơn khối lượng bên trái của nó. Ví dụ, magiê (trọng lượng nguyên tử 24,3) được đặt ở bên phải của natri (trọng lượng nguyên tử 23,0):
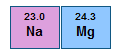
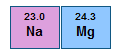
Mendeleev nhận ra rằng chiếc bàn trước mặt anh là trung tâm của môn hóa học. Và hơn thế nữa, Mendeleev thấy rằng bảng của mình chưa hoàn thiện – có những khoảng trống mà các nguyên tố nên có, nhưng không ai phát hiện ra chúng.
Cũng giống như Adams và Le Verrier có thể được cho là đã phát hiện ra hành tinh Neptune trên giấy, Mendeleev có thể được cho là đã phát hiện ra germanium trên giấy. Ông gọi nguyên tố mới này là eka-silicon , sau khi quan sát thấy một khoảng trống trong bảng tuần hoàn giữa silicon và thiếc:


Tương tự, Mendeleev đã phát hiện ra gali ( eka -alumin) và scandium ( eka -boron) trên giấy, bởi vì ông đã dự đoán sự tồn tại và tính chất của chúng trước khi khám phá thực tế.
Mặc dù Mendeleev đã tạo ra một bước đột phá quan trọng, nhưng anh ấy đã tiến bộ hơn một chút. Với lợi ích của nhận thức muộn màng, chúng ta biết rằng bảng tuần hoàn của Mendeleev được củng cố bởi suy luận sai lầm. Mendeleev đã tin, không chính xác, rằng các đặc tính hóa học được xác định bởi trọng lượng nguyên tử. Tất nhiên, điều này hoàn toàn hợp lý khi chúng ta xem xét kiến thức khoa học vào năm 1869.
Năm 1869, bản thân electron vẫn chưa được phát hiện – điều đó xảy ra 27 năm sau, vào năm 1896.
Trên thực tế, phải mất 44 năm để tìm ra lời giải thích chính xác về các dạng thông thường trong bảng tuần hoàn của Mendeleev.
Lời giải thích được đưa ra vào năm 1913 từ Henry Moseley, người đã bắn các electron vào nguyên tử, dẫn đến việc phát ra tia X. Moseley phát hiện ra rằng mỗi nguyên tố ông nghiên cứu đều phát ra tia X ở một tần số riêng.
Khi xem xét các tần số do một loạt nguyên tố phát ra, ông nhận thấy một mô hình được giải thích tốt nhất nếu điện tích dương trong hạt nhân tăng lên đúng một đơn vị từ nguyên tố này sang nguyên tố khác.
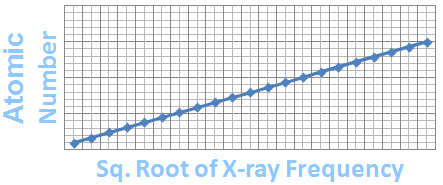

Nói cách khác, Moseley đã phát hiện ra rằng các nguyên tố khác nhau vì nguyên tử của chúng có số proton khác nhau. Ông phát hiện ra rằng vị trí của các nguyên tố trong bảng tuần hoàn được dự đoán bằng số nguyên tử tốt hơn trọng lượng nguyên tử của chúng. (Số nguyên tử của một nguyên tố bằng số proton, và do đó là electron, trong một trong các nguyên tử của nó.)
Khám phá của Moseley đã giải tỏa các vấn đề về coban-niken và argon-kali.
Xét bài toán argon-kali, người ta biết rằng argon có khối lượng nguyên tử lớn hơn kali. Theo lý luận của Mendeleev, argon nên được xếp sau kali trong bảng tuần hoàn. Nhưng, làm điều này không có ý nghĩa gì về tính chất hóa học.
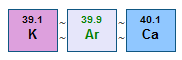

Công trình của Moseley đã chỉ ra rằng số nguyên tử của argon là 18 và của kali là 19. Vì vậy, argon nên được đặt trước kali trong bảng tuần hoàn dựa trên số nguyên tử. Các nhà hóa học trên khắp thế giới thở phào nhẹ nhõm vì điều này đồng ý với các đặc tính hóa học quan sát được của các nguyên tố này.


Moseley cũng mô phỏng thành tích của Mendeleev trong việc khám phá các nguyên tố mới trên giấy, tìm ra 4 số nguyên tử không có nguyên tố nào trùng khớp. Ông đã tiên đoán sự tồn tại của các nguyên tố có số hiệu nguyên tử 43, 61, 72 và 75. Những nguyên tố này thực sự đã được khám phá ra; bây giờ chúng ta gọi chúng là tecneti, promethium, hafnium và rheni.
Ngày nay, các nguyên tố hóa học vẫn được sắp xếp theo thứ tự tăng dần số hiệu nguyên tử (Z) khi chúng ta nhìn từ trái sang phải trong bảng tuần hoàn. Chúng tôi gọi các khoảng thời gian hàng ngang . Ví dụ, đây là Tiết 4:
![]()
![]()
Ví dụ, đây là Nhóm 2:


Bây giờ chúng ta cũng biết rằng hóa học của một nguyên tố được xác định bởi cách sắp xếp các electron của nó – cấu hình electron của nó .
Các electron trong nguyên tử có thể được hình dung như các lớp hoặc lớp vỏ bao quanh hạt nhân nguyên tử. Điều này được thể hiện trong sơ đồ nguyên tử liti ở phía bên trái của trang này. Chúng ta hình dung các electron như những hành tinh nhỏ quay xung quanh một hạt nhân giống như mặt trời, đó là nơi chứa các proton và neutron. Đây được gọi là biểu diễn Bohr của nguyên tử. Đây thực sự là một con số gần đúng, nhưng nó là một điểm khởi đầu tốt để hiểu các tính chất hóa học của các nguyên tố.
Nếu loại trừ các nguyên tố kim loại chuyển tiếp, chúng ta có thể nói rằng các nguyên tử chiếm cùng một nhóm của bảng tuần hoàn có cùng số electron lớp ngoài cùng. Ví dụ, tất cả các nguyên tố trong Nhóm 2, được hiển thị bên trái, có hai electron ngoài cùng.
Các điện tử ngoài cùng này được gọi là các điện tử hóa trị .
Đó là các điện tử hóa trị gây ra phản ứng hóa học.
Tất cả các nguyên tố trong nhóm 1 đều có một electron hóa trị; Nhóm 2, hai electron hóa trị; Nhóm 13, ba electron hóa trị; Nhóm 14, bốn electron hóa trị; Nhóm 15, năm electron hóa trị; Nhóm 16, sáu electron hóa trị; Nhóm 17, bảy electron hóa trị; và Nhóm 18, tám electron hóa trị, ngoại trừ heli, có hai.
Nhóm 18 là nhóm khí quý, một nhóm các nguyên tố không hoạt động. Sự miễn cưỡng của các khí trơ để phản ứng hóa học là chìa khóa để mở sự hiểu biết của chúng ta về lý do tại sao các yếu tố khác làm phản ứng.
Các khí quý không phản ứng, vì lớp vỏ electron bên ngoài của chúng đã đầy. Một lớp vỏ đầy đủ các electron bên ngoài là một sự sắp xếp đặc biệt ổn định. Điều này có nghĩa là các nguyên tử khí cao quý không dễ dàng đạt được hay mất đi các electron; chúng phản ứng với các nguyên tử khác rất khó, hoặc hoàn toàn không.
Các nguyên tử khác mất điện tử, giành được điện tử hoặc chia sẻ điện tử để đạt được cấu hình điện tử giống như khí quý – khi làm như vậy, chúng hình thành liên kết hóa học và tạo ra chất mới.


Ví dụ, trong sơ đồ trên, một nguyên tử natri mất điện tử hóa trị duy nhất của nó cho một nguyên tử clo. Khi một nguyên tử mất hoặc nhận thêm một hoặc nhiều electron, nó không còn có thể được mô tả như một nguyên tử nữa – nó được gọi là ion .


Vì nguyên tử natri của chúng ta đã mất một điện tử mang điện tích âm, nên nó trở thành một ion natri tích điện dương: Na + . Ion natri này, với ít hơn một điện tử so với nguyên tử natri, có cấu hình electron giống như neon khí quý và bền về mặt hóa học.
Nguyên tử clo, bắt đầu với bảy electron hóa trị, nhận một electron độc thân và trở thành ion clo tích điện âm: Cl – . Ion này có cấu hình electron giống như argon khí quý, và do đó ion này cũng bền về mặt hóa học.
Ion natri tích điện dương và ion clo tích điện âm hút nhau về mặt tĩnh điện, tạo thành hợp chất hóa học ổn định, natri clorua. Các liên kết tĩnh điện này được gọi là liên kết ion .
Đối với các kim loại chuyển tiếp, tình hình phức tạp hơn một chút so với những gì được mô tả ở trên, bởi vì các điện tử từ các lớp vỏ thấp hơn trong nguyên tử kim loại chuyển tiếp có thể trở thành các điện tử hóa trị. Đây là lý do tại sao, ví dụ, chúng ta có thể nhận được các loại ion đồng, Cu + và Cu 2+ , và các ion sắt, Fe 2+ và Fe 3+ .
Số lượng các electron hóa trị trong nguyên tử là cơ sở của các mẫu thông thường mà Mendeleev quan sát được vào năm 1869, các mẫu cuối cùng đã cho chúng ta bảng tuần hoàn hiện đại.

Xem thêm:
Giáo viên trường chuyên mách chiến lược giải đề Vật lý tốt nghiệp THPT