- Nước phân ly rất yếu thành các ion hydro và hydroxit. Nồng độ của các ion trong nước trung tính bằng nhau (= mol trên lít). Sự điện phân liên quan đến các hạt tải điện, cho dòng điện chạy qua. Vì vậy, nước có một lượng rất nhỏ các ion là chất dẫn điện không tốt. Vì vậy, quá trình điện phân nước tinh khiết sẽ rất chậm.
- Ion hydro liên kết với phân tử nước khác và tồn tại dưới dạng ion hydronium. Vì vậy, bất kỳ ion hydroxit nào, di chuyển về phía cực dương, sẽ bị trung hòa bởi ion hydronium, ngay cả trước khi nó đến cực dương để tạo thành khí oxy. Tương tự, bất kỳ hydro nào có mặt sẽ bị trung hòa bởi ion hydroxyl có mặt gần catốt và không bị khử thành hydro. Vì vậy, sự điện phân của nước thành hydro và oxy sẽ rất nhỏ. Quá trình điện phân cũng liên quan đến việc chuyển các electron từ anion sang anot và catot thành cation.
- Trong quá trình điện phân nước, các điện cực là chất rắn trơ như platin / paladi trong khi chất điện phân là chất tan trong dung dịch và sản phẩm là chất khí.
Contents
Các yếu tố ảnh hưởng đến hiệu quả của quá trình điện phân
Hiệu suất của quá trình điện phân hay sự chuyển electron phụ thuộc vào nhiều yếu tố như;
i) Số cation và anion hiện có trong dung dịch.
ii) Tốc độ di chuyển của các ion đến điện cực.
iii) Năng lượng hoạt hóa cần thiết cho sự chuyển điện tử từ điện cực sang các ion chất điện ly.
iv) Ảnh hưởng của bong bóng khí bao quanh điện cực lên bộ truyền điện xa hơn, v.v.
Việc giao nhau giữa một số giao diện (chất tan – lỏng, chất tan – rắn, rắn – khí) dẫn đến việc tăng nhu cầu năng lượng cho quá trình điện phân (quá áp) so với dự đoán của năng lượng Gibbs nhiệt động lực học.
Điện phân nước – Tiềm năng tế bào và tính khả thi về nhiệt động lực học
Một nửa phản ứng trong quá trình điện phân nước tinh khiết ở pH = 7 và ở 25 ° Care-
Ở catot: 2H 2 O (l) + 2e – → H 2 (g) + 2OH – E ° = -0,42 V
Tại anot: 2H 2 O → O 2 (g) + 4H + + 4e – E ° = +0,82 V
Phản ứng thực của quá trình điện phân nước được cho là;
2H 2 O (l) → 2H 2 (g) + O 2 (g) E ° = -1,24 V
Điện thế tế bào của quá trình điện phân nước tinh khiết là âm và do đó không thuận lợi về mặt nhiệt động lực học. Do nồng độ của các ion thấp và các giao diện được vượt qua các điện tử, một điện áp phụ (Quá áp) ở mỗi điện cực là cần thiết vào khoảng 0,6V.
Trong thực tế, chỉ có thể điện phân liên tục nước nguyên chất ở hiệu điện thế ngoài 2,4V. Vì quá trình điện phân nước tinh khiết là không khả thi về mặt nhiệt động lực học, các phương pháp để làm cho nó khả thi về mặt động học đang được nghiên cứu.
Một trong những phương pháp là tăng độ dẫn điện bằng cách tăng số lượng ion có sẵn bằng cách thêm axit, bazơ hoặc muối không phản ứng.
Điện phân nước khi có axit (pH thấp hơn 7)
Các ion hydro bổ sung từ axit sẽ bị khử ở cực âm trong khi nước sẽ bị ôxy hóa ở cực dương. Một nửa phản ứng trong môi trường axit là;
Ở cực âm: 2H + + e – → H 2 E ° = +0,0 V
Tại anot: 2H 2 O → O 2 (g) + 4H + + 4e – E ° = +1,23 V
Phản ứng thuần được viết dưới dạng 2H 2 O → O 2 (g) + 2H 2 E ° = -1,23 V
Quá trình điện phân diễn ra ở điện thế thấp hơn nhiều so với nước nguyên chất (2,4V).
Điện phân nước khi có bazơ (pH cao hơn 7)
Các ion hydroxyl bổ sung, giải phóng các điện tử của chúng đến cực dương, trong khi các điện tử ở cực âm sẽ oxy hóa các phân tử nước gần nó. Một nửa phản ứng của quá trình điện phân với sự có mặt của bazơ là-
Ở catot: 2H 2 O (l) + 2e – → H 2 (g) + 2OH – E ° = -0,83 V
Ở cực dương: 4OH – → O 2 + 2H 2 O + 4e – E ° = +0,4 V
Thực tế phản ứng là 2H 2 O → O 2 (g) + 2H 2 E ° = -1,23 V
Giống như điện phân trong môi trường axit, điện phân trong môi trường bazơ cũng cần điện thế thấp hơn nhiều.
Biểu đồ Pourbaix cung cấp các vùng cân bằng của nước, hydro và oxy ở các thế điện cực khác nhau.


Điện phân nước khi có muối
Các muối phân ly 100% thành cation và anion trong nước và do đó làm tăng nồng độ ion để tăng độ dẫn điện. Nhưng các cation và anion từ muối cũng sẽ bị hút về phía các điện cực và do đó trở thành đối thủ cạnh tranh với sự phân hủy của nước để tạo ra hydro và oxy. Vì vậy, việc lựa chọn các muối có các ion không cạnh tranh trở nên cần thiết.
Các muối có chứa thế điện cực tiêu chuẩn thấp hơn so với các ion hydro và hydroxit thích hợp cho quá trình điện phân nước.
Các ion của nguyên tố nhóm thứ nhất và thứ hai (Li, Na, K, Mg, Ca, Ba, v.v.) có thế tiêu chuẩn thấp hơn ion hydro và sẽ không bị khử và cho phép ion hydro từ nước thành hydro.
Các anion không phản ứng như các ion nitrat, sulphat có thế khử tiêu chuẩn thấp hơn các ion hydroxit. Sự oxi hóa sunfat thành peroxy-sulphat có thế khử + 2.1V.
Các hợp chất ion cao phân tử rắn, không hòa tan (Nafion), đã được phát hiện để giúp điện phân nước ở nhiệt độ dưới 1,5V.
Điện phân nước bằng chất xúc tác điện
Chất xúc tác điện là chất làm tăng tốc độ phản ứng điện hóa mà không bị tiêu hao trong phản ứng như chất xúc tác trong các phản ứng hóa học. Chất xúc tác thực hiện phản ứng thông qua một con đường khác có năng lượng hoạt hóa thấp hơn. Diện tích bề mặt cao, trung tâm hoạt hóa lớn hơn là khả năng của chất xúc tác trong việc tăng khả năng phản ứng.
Hoạt động của điện cực trơ như bạch kim có thể được tăng cường bằng cách sửa đổi bề mặt bằng cách
i) Tăng diện tích bề mặt bằng các hạt nano hoặc tạo hợp kim với các nguyên tố khối d xúc tác và thay đổi trạng thái điện tử được phủ bằng chất xúc tác khác để tăng cường điện phân.
ii) Phủ bề mặt điện cực bằng các chất có hoạt tính xúc tác, như enzym.
Máy điện phân
Tế bào điện phân được sử dụng để điện phân nước là bình điện phân. Tùy thuộc vào người vận chuyển chất điện phân, chất điện phân có thể được chia thành ba loại;
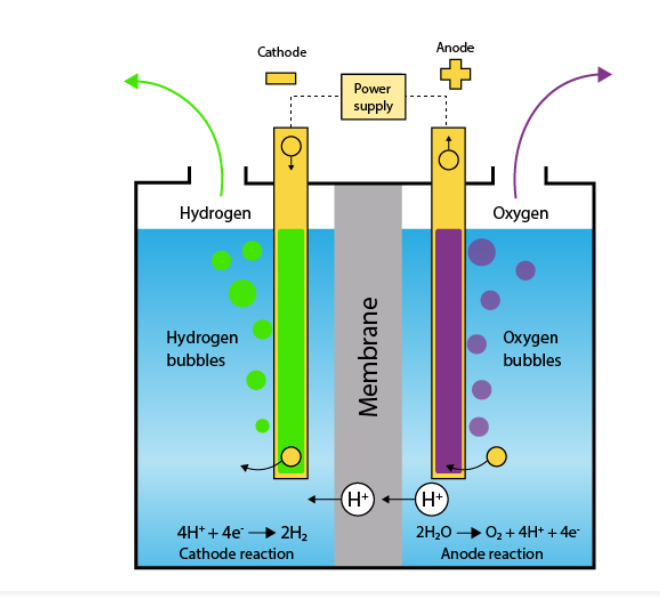
Máy điện phân màng polyme Electrolyte (PEM)
Một polyme như Nafion ngăn cách các điện cực và cho phép các ion hydro được hình thành do quá trình oxy hóa nước ở cực dương đi qua nó đến ngăn cực âm để phóng điện và tạo thành khí hydro.
Máy điện phân kiềm
Natri (hoặc kali) hydroxit trong nước loãng được sử dụng trong quá trình điện phân cung cấp và di chuyển các ion hydroxit đến cực dương để tạo thành oxy.
Máy điện phân oxit rắn
Ôxít gốm ngăn cách các điện cực. Ở cực âm, nước bị khử thành các ion hydro và oxit. Các ion oxit đi qua oxit gốm đến cực dương để trở thành khí oxi. Điều này được sử dụng ở nhiệt độ cao từ 700 đến 800 ° C để giảm điện áp bên ngoài cần thiết cho quá trình điện phân.