Natri axetat (CH3COONa) – học hóa dễ hiểu
1 Tháng Mười Hai, 2021Contents Natri Axetat là gì (CH3COONa)? Ch3COONa là một hợp chất hóa học có tên hóa học Natri Axetat....
Contents
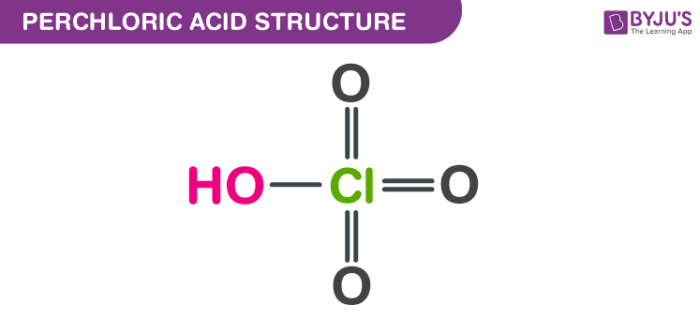
HClO4 là một oxoacid clo với tên hóa học Axit Perchloric. Nó còn được gọi là axit Hyperchloric (HClO4) hoặc hydroxidotrioxidochlorine. Giữa 50% -72% axit là một dung dịch nước không màu không mùi rõ ràng. Nó ăn mòn mô và kim loại. Khi các thùng chứa kín tiếp xúc với nhiệt trong một thời gian dài có thể bị vỡ dữ dội.
| HClO4 | Axit perchloric |
| Trọng lượng phân tử của HClO4 | 100,46 g/mol |
| Mật độ axit Perchloric | 1,768 g/cm3 |
| Điểm nóng chảy của axit Perchloric | −17 °C |
| Điểm sôi của axit Perchloric | 203 °C |

Ở cấp độ công nghiệp, nó có thể được sản xuất theo hai phương pháp. Trong phương pháp truyền thống sử dụng đầy đủ độ hòa tan nước cao của natri perchlorate (NaClO4). Xử lý dung dịch này bằng axit clohydric (HCl) tạo ra axit perchloric bằng cách kết tủa natri clorua rắn. Phản ứng như sau:
Phương pháp khác trực tiếp hơn và tránh xa muối và yêu cầu dung dịch clo oxy hóa anodic tại điện cực bạch kim.
Nó cũng có thể được điều chế trong các phòng thí nghiệm bằng cách điều trị bari perchlorate (Ba (ClO4)2) với axit sulphuric (H2như vậy4) kết tủa bari sunfat (BaSO4) và để lại axit perchloric. Xen kẽ nó có thể được chuẩn bị bằng cách trộn axit nitric (HNO3) với amoni perchlorate (NH4ClO4) và thêm axit clohydric trong khi đun sôi.
Hít phải hơi của hợp chất này gây ra cảm giác nóng rát ở cổ họng và mũi, kích ứng trong phổi cùng với ho. Tiếp xúc kéo dài gây nôn mửa. Ăn hợp chất này có thể gây phồng rộp và bỏng trong dạ dày. Khi đun nóng, nó giải phóng khí ăn mòn, gây kích ứng và độc hại.
Ứng dụng chính của axit perchloric là việc sử dụng nó như một tiền thân của amoni perchlorate, là một hợp chất vô cơ là một thành phần quan trọng của nhiên liệu tên lửa. Do đó, axit perchloric được coi là một hợp chất hóa học rất quan trọng trong ngành công nghiệp vũ trụ. Hợp chất này cũng được sử dụng trong khắc các hệ thống hiển thị tinh thể lỏng (thường được viết tắt là LCD). Do đó, axit perchloric cũng được sử dụng rộng rãi trong ngành công nghiệp điện tử. Hợp chất này cũng được sử dụng trong hóa học phân tích do tính chất độc đáo của nó. Axit perchloric cũng có một số ứng dụng quan trọng trong việc khai thác vật liệu từ răng hàm của chúng. Hơn nữa, hợp chất này cũng được sử dụng trong khắc chrome. Vì nó hoạt động như một siêu axit, axit perchloric được coi là một trong những axit Bronsted-Lowry mạnh nhất.
Việc sản xuất công nghiệp axit perchloric thường đi theo một trong hai tuyến đường khác nhau. Tuyến đường đầu tiên, thường được gọi là tuyến đường truyền thống, là một phương pháp chuẩn bị axit perchloric khai thác độ hòa tan cực cao của natri perchlorate trong nước. Độ hòa tan của natri perchlorate trong nước tương ứng với 2090 gram mỗi lít ở nhiệt độ phòng. Điều trị dung dịch natri perchlorate như vậy trong nước bằng axit hydrochloric dẫn đến sự hình thành axit perchloric cùng với kết tủa natri clorua. Axit đậm đặc này, hơn nữa, có thể được tinh chế thông qua quá trình chưng cất. Tuyến thứ hai liên quan đến việc sử dụng các điện cực trong đó quá trình oxy hóa clo anodic được hòa tan trong nước diễn ra tại một điện cực bạch kim. Tuy nhiên, phương pháp thay thế được coi là đắt hơn.
Axit perchloric là một chất oxy hóa cực kỳ mạnh. Do đặc tính oxy hóa mạnh mẽ của nó, hợp chất này thể hiện khả năng hoạt động rất cao đối với hầu hết các kim loại. Hơn nữa, hợp chất này cũng phản ứng cao đối với chất hữu cơ. Hợp chất này có thể ăn mòn về phía da. Do đó, các biện pháp an toàn đầy đủ phải được thực hiện trong quá trình xử lý hợp chất này.
Xem thêm: