Tính chất và công dụng của Phosphate – PO43- chi tiết nhất
18 Tháng Mười Một, 2021Contents Phosphate là gì (PO)43-)? Po43- là một dẫn xuất hóa học của axit photphoric với tên hóa học Phosphate....
Contents
Amoniac là một loại khí không màu với công thức hóa học NH3.
Nó bao gồm hydro và nitơ. Ở dạng nước, nó được gọi là amoni hydroxit. Hợp chất vô cơ này có mùi hăng. Ở dạng cô đặc, nó nguy hiểm và ăn da.
Amoniac nhẹ hơn không khí với mật độ 0,769 kg / m3 tại STP. Nó được sử dụng rộng rãi như một loại phân bón. Nó cũng được sử dụng trong sản xuất chất nổ như nitrocellulose và TNT. Ngoài ra, nó được sử dụng trong sản xuất tro soda và trong quá trình Ostwald để có được axit nitric.
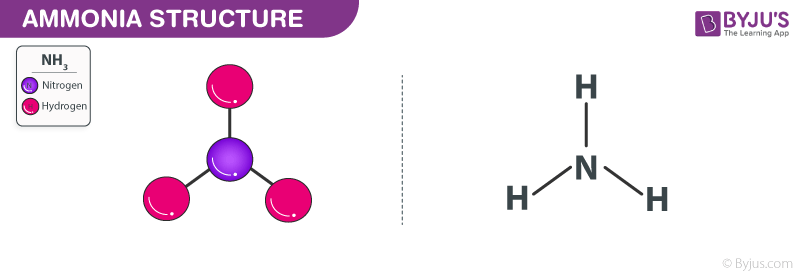

Cấu trúc amoniac
| Nh3 | Amoniac |
| Trọng lượng phân tử / Khối lượng mol | 17,031 g/mol |
| mật độ | 0,73 kg/m³ |
| Điểm sôi | -33,34 °C |
| Điểm nóng chảy | −77,73 °C |
Amoniac được biết là hoạt động như một baơ yếu vì nó kết hợp với nhiều axit để tạo thành muối. Ví dụ, khi nó được phản ứng với axit hydrochloric, amoniac được chuyển đổi thành amoni clorua. Tất cả các muối được sản xuất từ các phản ứng axit-bay như vậy được biết là có chứa cation amoni, được biểu thị bằng NH4+. Thật thú vị khi lưu ý rằng amoniac cũng thể hiện chất lượng axit yếu và do đó, có thể được coi là một hợp chất amphoteric. Chất lượng axit của amoniac cho phép nó hình thành giữa với một số kim loại kiềm và kim loại đất kiềm. Một ví dụ về phản ứng như vậy có thể được quan sát thấy khi lithium tiếp xúc với amoniac lỏng, kích hoạt sự hình thành liti amide (một hợp chất hóa học có công thức LiNH2).
Cũng có thể lưu ý rằng phân tử NH3 trải qua quá trình tự phân ly khi hòa tan trong nước. Sự tự động hóa phân tử của phân tử amoniac dẫn đến sự hình thành ba bên liên hợp của nó (NH2-) và axit liên hợp của nó(NH4+). Cấu trúc của cation amoni được minh họa dưới đây.
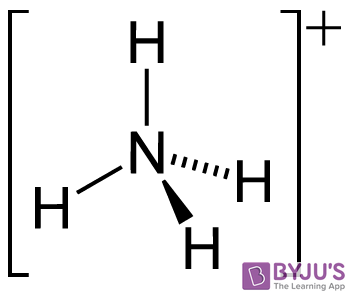

Quá trình tự động hóa này có thể được thể hiện bằng phản ứng cân bằng sau:
2NH3 ⇌ NH2– + NH4+
Vì amoniac thường hoạt động như một cơ sở tương đối yếu, nó có thể được sử dụng cho mục đích đệm (để kiểm soát thay đổi pH).
Amoniac dễ dàng được tạo ra trong phòng thí nghiệm bằng cách làm nóng muối amoni, chẳng hạn như amoni clorua NH4Cl có kiềm mạnh, chẳng hạn như natri hydroxit hoặc canxi hydroxit.
2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + 2NH3(g)
Khí cũng có thể được tạo ra bằng cách làm ấm amoni hydroxit đậm đặc.
Phương pháp thương mại chính để sản xuất amoniac là Quá trình Haber, sự kết hợp trực tiếp của nitơ và hydro dưới áp suất cao với sự hiện diện của chất xúc tác.
Tên hóa học của NH3 là amoniac. Nó còn được gọi là trihydridonitrogen và nitơ trihydride. Hợp chất này được biết đến là pnictogen hydride đơn giản nhất.
Một trong những ứng dụng quan trọng nhất của amoniac là việc sử dụng nó trong ngành nông nghiệp như một loại phân bón. Amoniac, ở dạng khan (hoặc đôi khi ở dung dịch nước hoặc dưới dạng muối ion), thường được trộn với đất nông nghiệp để tăng hàm lượng nitơ trong đất và do đó, độ phì nhiêu của đất. Điều này thường đi kèm với năng suất cây trồng cao hơn và chất lượng cây trồng tốt hơn. Hợp chất này cũng được sử dụng trong quá trình tổng hợp nhiều hợp chất quan trọng như hydrazine và hydro xyanua.
Cho đến đầu những năm 1900, amoniac chủ yếu được sản xuất thông qua việc chưng cất khô các sản phẩm chất thải động vật cùng với một số chất thải thực vật giàu nitơ. Việc chưng cất các chất thải này dẫn đến việc giảm nitrit và axit nitrous cùng với hydro. Cuối cùng, amoniac thu được như một sản phẩm. Ngày nay, amoniac được sản xuất công nghiệp thông qua quá trình Haber-Bosch, liên quan đến phản ứng trong pha khí giữa nitơ phân tử và hydro phân tử. Điều quan trọng cần lưu ý là phản ứng này diễn ra ở nhiệt độ tương đối cao và áp suất cao (theo thứ tự 450 độ C và hơn 10000 kilopascals).
Amoniac lỏng là dung môi ion hóa không nước được nghiên cứu phổ biến nhất và được biết đến nhiều nhất. Tính chất đáng chú ý nhất của hợp chất này là khả năng hòa tan kim loại kiềm để tạo thành các dung dịch dẫn điện, có màu sắc mạnh có chứa các electron đã giải quyết. Bên cạnh các giải pháp đáng chú ý này, phần lớn hóa học của amoniac lỏng có thể được mô tả với sự trợ giúp của dung dịch nước bằng cách so sánh với các phản ứng tương tự.
Amoniac được biết là tự nhiên xảy ra ở nhiều nơi trong môi trường như đất, không khí và trong thảm thực vật. Cũng có thể lưu ý rằng cơ thể con người tự nhiên tạo ra amoniac trong khi phá vỡ các mặt hàng thực phẩm có chứa protein thành axit amin. Amoniac này sau đó được chuyển đổi thành urê. Điều quan trọng cần lưu ý là amoniac và, bằng cách mở rộng, ion amoni là thành phần quan trọng của nhiều quá trình trao đổi chất quan trọng ở người.
Khi hít phải nồng độ amoniac lớn, các triệu chứng phổ biến nhất phát sinh bao gồm bỏng cổ họng, mũi và đường hô hấp ngay lập tức. Cuối cùng, điều này có thể dẫn đến suy hô hấp hoặc suy hô hấp. Nếu nồng độ amoniac trong khí quyển thấp, các tác dụng phụ thường gặp là kích ứng cổ họng và kích ứng mũi.
Xem thêm: