Contents
Axit và bazơ là gì?
Axit là bất kỳ chất nào chứa hydro có khả năng cho một proton (ion hydro) cho một chất khác. Bazơ là phân tử hoặc ion có thể nhận ion hydro từ axit.
Các chất có tính axit thường được nhận biết bằng vị chua của chúng. Về cơ bản, axit là một phân tử có thể tạo ra ion H + và có thể duy trì năng lượng thuận lợi sau khi mất H +. Axit được biết là làm xanh quỳ tím đỏ.
Mặt khác, bazơ được đặc trưng bởi vị đắng và kết cấu trơn. Một bazơ có thể hòa tan trong nước được gọi là kiềm. Khi các chất này phản ứng hóa học với axit, chúng tạo ra muối. Bazơ đã biết làm quỳ tím hóa đỏ.
Trong cuộc sống hàng ngày, chúng ta sử dụng nhiều hợp chất mà các nhà khoa học gọi là axit. Nước cam hoặc bưởi bạn uống vào bữa sáng có chứa axit xitric (còn được gọi là Vitamin C). Khi sữa chuyển sang vị chua, nó có chứa axit lactic. Giấm được sử dụng trong nước sốt xà lách có chứa axit axetic . Theo đó, liên kết hóa học được coi là được tạo thành từ sự kết hợp axit-bazơ. Do đó, các thuộc tính của phân tử có thể được hiểu bằng cách chia nó thành các đoạn axit và bazơ.
Axit và bazơ là gì?
Axit là bất kỳ chất nào chứa hydro có khả năng cho một proton (ion hydro) cho một chất khác. Bazơ là phân tử hoặc ion có thể nhận ion hydro từ axit.
Các chất có tính axit thường được nhận biết bằng vị chua của chúng. Về cơ bản, axit là một phân tử có thể tạo ra ion H + và có thể duy trì năng lượng thuận lợi sau khi mất H + . Axit được biết là làm xanh quỳ tím đỏ.
Mặt khác, bazơ được đặc trưng bởi vị đắng và kết cấu trơn. Một bazơ có thể hòa tan trong nước được gọi là kiềm. Khi các chất này phản ứng hóa học với axit, chúng tạo ra muối. Bazơ đã biết làm quỳ tím hóa đỏ.
Hóa học định nghĩa axit
Thuật ngữ axit và bazơ đã được định nghĩa theo nhiều cách khác nhau, tùy thuộc vào cách nhìn cụ thể về tính chất của tính axit và tính bazơ. Arrhenius đầu tiên định nghĩa axit là các hợp chất ion hóa để tạo ra các ion hydro và bazơ là các hợp chất ion hóa để tạo ra các ion hydroxit. Theo định nghĩa của Lowry-Bronsted, axit là chất cho proton và bazơ là chất nhận proton.
Theo định nghĩa Lewis, axit là phân tử hoặc ion có khả năng phối hợp với các cặp điện tử không chia sẻ và bazơ là phân tử hoặc ion có các cặp điện tử không chia sẻ sẵn sàng để chia sẻ với axit. Để có tính axit theo nghĩa Lewis, một phân tử phải thiếu điện tử. Đây là khái niệm bazơ axit chung nhất. Tất cả các axit Lowery Bronstead đều là axit Lewis nhưng ngoài ra, định nghĩa Lewis còn bao gồm nhiều thuốc thử khác như bo triflorua, nhôm clorua, v.v.
Các lý thuyết về axit và bazơ
Ba lý thuyết khác nhau đã được đưa ra để xác định axit và bazơ. Những lý thuyết này bao gồm lý thuyết Arrhenius, lý thuyết Bronsted-Lowry và lý thuyết Lewis về axit và bazơ. Mô tả ngắn gọn về mỗi lý thuyết này được cung cấp trong tiểu mục này. Axit và bazơ có thể được xác định thông qua ba lý thuyết khác nhau.
- Các lý thuyết Arrhenius về axit và bazơ bang rằng “một loại axit tạo ra H + ion trong dung dịch trong khi một cơ sở sản xuất một OH – ion trong dung dịch của nó”.
- Các Bronsted-Lowry lý thuyết định nghĩa “một loại axit như một prôton và một căn cứ như một chất nhận proton”.
- Cuối cùng, định nghĩa của Lewis về axit và bazơ mô tả “axit là chất nhận cặp điện tử và bazơ là chất cho cặp điện tử”.
Cũng kiểm tra ⇒ Axit loãng
pH của axit và bazơ
Để tìm giá trị số của mức độ axit hoặc tính bazơ của một chất, có thể sử dụng thang đo pH (trong đó pH là viết tắt của ‘thế hydro’). Thang đo pH là cách phổ biến và đáng tin cậy nhất để đo mức độ axit hoặc bazơ của một chất. Một biện pháp quy mô pH có thể khác nhau 0-14 , trong đó 0 là axit nhất và 14 là một chất cơ bản nhất có thể được.
Một cách khác để kiểm tra xem một chất là axit hay bazơ là sử dụng giấy quỳ. Có hai loại giấy quỳ có thể dùng để nhận biết axit và bazơ – giấy quỳ đỏ và giấy quỳ xanh. Giấy quỳ xanh chuyển sang đỏ trong điều kiện axit và giấy quỳ đỏ chuyển sang xanh trong điều kiện bazơ hoặc kiềm.
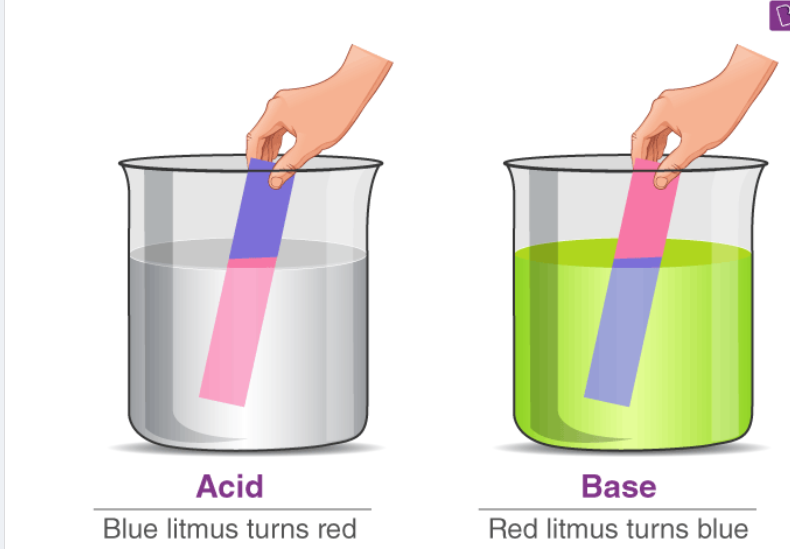

Giấy quỳ thử nghiệm axit và bazơ
Tính chất của axit và bazơ
1. Tính chất của Axit
- Axit có bản chất ăn mòn.
- Chúng là chất dẫn điện tốt.
- Giá trị pH của chúng luôn nhỏ hơn 7.
- Khi phản ứng với kim loại, các chất này tạo ra khí hiđro.
- Axit là chất có vị chua.
- Ví dụ: Axit sunfuric [H 2 SO 4 ], axit clohydric [HCl], axit axetic [CH 3 COOH].
2. Thuộc tính của Căn cứ
Một số thuộc tính, như vị đắng, thuộc sở hữu của tất cả các cơ sở. Các cơ sở cũng cảm thấy trơn trượt. Mơ thấy xà phòng trơn trượt đánh đề con gì. Và đây là một nền tảng. Hơn nữa, khi ngâm trong nước, bazơ dẫn điện vì chúng bao gồm các hạt mang điện trong dung dịch.
- Chúng được phát hiện có kết cấu như xà phòng khi chạm vào.
- Các chất này giải phóng các ion hydroxit (ion OH – ) khi hòa tan trong nước.
- Trong dung dịch nước của chúng, bazơ đóng vai trò là chất dẫn điện tốt.
- Giá trị pH tương ứng với bazơ luôn lớn hơn 7.
- Bazơ là những chất có vị đắng, có khả năng làm xanh giấy quỳ đỏ.
- Ví dụ: Natri hiđroxit [NaOH], sữa magie [Mg (OH) 2 ] , canxi hiđroxit [Ca (OH) 2 ].
3. Chất trung tính
Chất trung tính là chất không có tính axit hoặc bazơ, có cùng số lượng ion hiđro và hiđroxyl, không làm đổi màu bề mặt quỳ tím.
- Những chất này không hiển thị bất kỳ đặc tính axit hoặc cơ bản nào.
- Giá trị pH của chúng xấp xỉ 7.
- Chất trung tính không có tác dụng làm xanh giấy quỳ tím đỏ.
- Độ pH của nước tinh khiết chính xác là 7.
- Ví dụ: Nước, muối thường (NaCl)
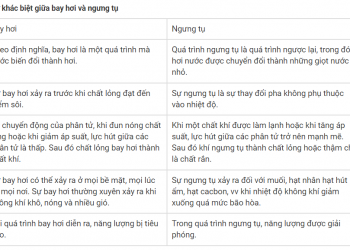
Sự khác biệt giữa axit và bazơ
| Axit | Căn cứ |
| Axit tạo ra các ion hydro khi hòa tan trong nước. | Bazơ sinh ra ion hydroxyl khi hòa tan trong nước. |
| Nó chuyển màu xanh của giấy quỳ thành màu đỏ. | Nó chuyển màu đỏ của giấy quỳ thành màu xanh. |
| Nó có một vị chua. | Nó có vị đắng và xà phòng khi chạm vào. |
| Giá trị pH của nó nằm trong khoảng từ 1 đến 7. | Giá trị pH của nó nằm trong khoảng từ 7 đến 14. |
| Ví dụ: HCl, H2SO4 v.v. | Ví dụ: NaOH, KOH, v.v. |
Khái niệm Arrhenius về Axit và Bazơ
- Nhà khoa học Thụy Điển Svante August Arrhenius đã định nghĩa axit là chất làm tăng nồng độ ion H + của nước khi hòa tan trong nước.
- Các proton này tiếp tục tạo thành các ion hydronium (H 3 O + ) bằng cách kết hợp với các phân tử nước.
- Tương tự, định nghĩa Arrhenius về một bazơ nói rằng bazơ là những chất khi hòa tan trong nước sẽ làm tăng nồng độ của ion OH – trong đó.
- Một trong những điểm đáng khen của lý thuyết này là nó giải thích thành công phản ứng giữa axit và bazơ tạo ra muối và nước.
- Một hạn chế quan trọng của định nghĩa Arrhenius về axit và bazơ là nó không giải thích được cách các chất thiếu ion hydroxit tạo thành dung dịch bazơ khi hòa tan trong nước, chẳng hạn như NO 2 – và F – .
Lý thuyết Bronsted Lowry về Axit và Bazơ
- Lý thuyết Bronsted-Lowry định nghĩa một axit là chất cho proton.
- Một cơ sở được định nghĩa là chất nhận proton (hoặc chất nhận ion H + ) theo lý thuyết này.
- Axit Bronsted trải qua quá trình phân ly để nhường proton và do đó làm tăng nồng độ của ion H + trong dung dịch.
- Mặt khác, bazơ Bronsted chấp nhận proton từ nước (dung môi) để tạo ra các ion hydroxit.
- Một lợi thế của định nghĩa Bronsted-Lowry về axit và bazơ là khả năng giải thích bản chất axit hoặc bazơ của các dạng ion.
- Một hạn chế quan trọng của lý thuyết này là nó không giải thích được cách các hợp chất thiếu hydro thể hiện tính chất axit, chẳng hạn như BF 3 và AlCl 3 .
Khái niệm về axit và bazơ của Lewis
- Định nghĩa của Lewis về một axit nói rằng nó là một loài có một quỹ đạo trống và do đó, có khả năng nhận một cặp điện tử.
- Bazơ Lewis là một loài chứa một cặp điện tử duy nhất và do đó, có thể hoạt động như một nhà tài trợ cặp điện tử.
- Lý thuyết này không liên quan đến nguyên tử hydro trong định nghĩa của nó về axit và bazơ.
- Các axit Lewis có bản chất là ái điện trong khi các Bazơ Lewis có chất lượng nucleophin.
- Ví dụ về axit Lewis: Cu 2+ , BF 3 và Fe 3+ . Ví dụ về bazơ Lewis: F – , NH 3 , và C 2 H 4 (etylen).
- Axit Lewis nhận một cặp điện tử từ gốc Lewis, tạo thành liên kết cộng hóa trị tọa độ trong quá trình này. Hợp chất tạo thành được gọi là chất cộng Lewis.
- Một ưu điểm đáng chú ý của khái niệm này là nhiều hợp chất có thể được định nghĩa là axit hoặc bazơ bởi nó. Tuy nhiên, nó cung cấp ít thông tin chi tiết về độ mạnh của các axit và bazơ này.
- Một trong những nhược điểm của lý thuyết này là nó không giải thích được phản ứng axit-bazơ không liên quan đến sự hình thành liên kết cộng hóa trị tọa độ.
Sử dụng axit và bazơ
Các ứng dụng khác nhau của axit và bazơ được liệt kê trong tiểu mục này.
1. Công dụng của Axit
- Giấm, một dung dịch pha loãng của axit axetic , có nhiều ứng dụng trong gia đình. Nó chủ yếu được sử dụng như một chất bảo quản thực phẩm.
- Axit citric là một phần không thể thiếu trong nước chanh và nước cam. Nó cũng có thể được sử dụng trong việc bảo quản thực phẩm.
- Axit sunfuric được sử dụng rộng rãi trong pin. Ắc quy được sử dụng để khởi động động cơ ô tô thường chứa axit này.
- Công nghiệp sản xuất chất nổ, thuốc nhuộm, sơn và phân bón liên quan đến việc sử dụng axit sunfuric và axit nitric.
- Axit photphoric là thành phần chính trong nhiều loại nước giải khát.
2. Công dụng của Căn cứ
- Việc sản xuất xà phòng và giấy liên quan đến việc sử dụng natri hydroxit. NaOH cũng được sử dụng trong sản xuất rayon.
- Ca (OH) 2 , còn được gọi là vôi tôi hoặc canxi hydroxit , được sử dụng để sản xuất bột tẩy trắng.
- Hỗn hợp khô được sử dụng trong sơn hoặc trang trí được tạo ra với sự trợ giúp của canxi hydroxit.
- Magie hydroxit, còn được gọi là sữa magie, thường được sử dụng như một loại thuốc nhuận tràng. Nó cũng làm giảm bất kỳ lượng axit dư thừa nào trong dạ dày của con người và do đó, được sử dụng như một loại thuốc kháng axit.
- Amoni hydroxit là một thuốc thử rất quan trọng được sử dụng trong phòng thí nghiệm.
- Bất kỳ độ chua dư thừa nào trong đất đều có thể được trung hòa bằng cách sử dụng vôi tôi.
Câu hỏi thường gặp – Câu hỏi thường gặp
Làm thế nào để bạn xác định axit và bazơ?
Để quyết định một chất là axit hay bazơ, trước và sau phản ứng, hãy đếm số hiđro của mỗi chất. Nếu giảm số lượng các hiđro, sản phẩm này là axit (cho các ion của hiđro). Nếu số lượng hydro đã tăng thì chất đó là nền tảng (chấp nhận các ion hydro).
Điều gì làm cho một thứ gì đó trở thành axit hoặc bazơ?
Một axit là một sản phẩm góp phần chứa các ion hydro. Bây giờ dung dịch chứa nhiều ion hydro hơn các ion hydroxit. Dạng dung dịch đó có tính axit. Nền là vật liệu có khả năng tiêu thụ các ion hydro. Khi một bazơ được hòa tan trong nước, cân bằng giữa các ion hydro và các ion hydroxit thay đổi theo hướng ngược lại.
Cơ sở và ví dụ là gì?
Natri hiđroxit, canxi cacbonat và kali oxit là những ví dụ về bazơ. Bazơ là vật liệu tương tác với các ion hydro và có thể trung hòa axit. Bazơ được phân loại là chất nhận proton (H +). Oxit kim loại và hiđroxit kim loại và amoni hiđroxit là những ví dụ điển hình của bazơ.
Axit là gì và các tính chất của nó?
Axit là những hợp chất ion khi tan trong nước tạo ra ion hiđro dương (H +) Khi tan trong nước, axit có vị chua, dẫn điện và phản ứng với kim loại tạo ra khí hiđro. Một số hợp chất chỉ thị có thể được sử dụng để phát hiện axit, chẳng hạn như giấy quỳ. Axit làm biến đổi giấy đỏ thành giấy quỳ xanh.
Sự khác biệt chính giữa axit và bazơ là gì?
Hai loại hợp chất ăn mòn là axit và bazơ. Bất kỳ vật liệu nào có giá trị pH từ 0 đến 7 được biết là có tính axit trong khi giá trị pH từ 7 đến 14 là bazơ. Axit là các hợp chất ion phân tách ra để tạo thành ion hydro (H +) trong nước.
Tầm quan trọng của axit là gì?
Axit đóng vai trò quan trọng trong cơ thể con người. Sự hiện diện của axit clohydric trong dạ dày giúp tiêu hóa bằng cách phá vỡ các phân tử thức ăn lớn và phức tạp. Axit amin cần thiết cho sự tổng hợp protein cần thiết để phát triển và sửa chữa các mô cơ thể.
Cơ sở và ví dụ là gì?
Natri hiđroxit, canxi cacbonat và kali oxit là những ví dụ về bazơ. Bazơ là chất phản ứng với ion hydro và có thể trung hòa axit. Hầu hết các bazơ là khoáng chất tạo thành nước và muối bằng cách phản ứng với axit. Bazơ bao gồm các oxit kim loại, hiđroxit và muối cacbonat.
Làm thế nào để bạn xác định một cơ sở?
Để xác định một chất là axit hay bazơ, trước và sau phản ứng, hãy đếm số hiđro của mỗi chất. Nếu số hiđro giảm dần thì chất này là axit (cho ion hiđro). Nếu số hiđro đã tăng thì chất này là cơ sở (chấp nhận ion của hiđro).
Xem thêm: