U tuyến núm vú ăn mòn là gì? Các nguyên nhân, triệu chứng và cách chữa bệnh
29 Tháng Một, 2021Contents Tổng quan về u tuyến núm vú ăn mòn U tuyến ăn mòn của núm vú là một...
Tổng quan về bệnh bạch cầu cấp tăng bạch cầu
Bệnh bạch cầu nguyên bào tủy cấp tính (cấp tính bệnh bạch cầu nguyên bào tủy, APL) là một loại bệnh bạch cầu cấp dòng tủy đặc biệt (AML), được nhóm cộng tác FAB chỉ định là bệnh bạch cầu dòng tủy cấp tính M3. Trong những năm gần đây, với việc không ngừng nâng cao hiểu biết về đặc tính sinh học của tế bào APL và cải tiến phương pháp điều trị, kết quả điều trị và tiên lượng đã được cải thiện đáng kể, tỷ lệ tử vong sớm giảm đáng kể.

Contents
APL nguyên nhân chính vẫn chưa hoàn toàn rõ ràng, thứ phát sau những nguyên nhân phổ biến trong hóa trị và (hoặc) xạ trị ở bệnh nhân ung thư , nhưng việc áp dụng các tác nhân alkyl hóa và chất ức chế topoisomerase Ⅱ cũng gây ra APL. Tiên lượng của APL thứ phát tốt hơn, và đáp ứng với điều trị và tỷ lệ sống sót lâu dài tương tự như ở bệnh nhân chính, nhưng nó khác đáng kể so với AML liên quan đến hóa trị.
APL là một loại bệnh bạch cầu đáp ứng tốt với liệu pháp biệt hóa gây ra, có liên quan đến sự thay đổi nhiễm sắc gây ra bởi protein dung hợp thụ thể axit retinoic (RARα) biểu hiện trong các tế bào APL. Năm lần chuyển đoạn nhiễm sắc thể của APL đã được báo cáo đều liên quan đến gen RARα trên nhiễm sắc thể 17. Gen có chiều dài 39398bp và chứa 9 exon và 8 intron. Chuyển vị t (15; 17) được thấy ở hầu hết bệnh nhân APL. Gen α của thụ thể axit retinoic và gen bệnh bạch cầu nguyên bào (PML) trên nhiễm sắc thể số 15 tạo thành gen dung hợp PML-RARα. Protein được mã hóa bởi gen dung hợp có Khác với chức năng của thụ thể tretinoin kiểu dại do alen RARα bình thường mã hóa. Gen RARα nằm ở vùng 21 của nhánh dài của nhiễm sắc thể số 17, và chức năng của nó là thụ thể hormone nhân. Tretinoin liên kết với các yếu tố thụ thể RAR và điều hòa phiên mã nhiều gen. PML là một protein hạt nhân, từ đầu cuối amin đến đầu tận cùng cacboxy, bao gồm vùng giàu proline, vùng giàu cystine cần thiết để định vị nucleosome, và cấu trúc xoắn và vị trí hạt nhân cần thiết để hình thành homo / heterodimer. Tín hiệu NLS và các vùng giàu serine và proline. PML thường nằm trong một cấu trúc được gọi là POD (miền sinh ung thư PML) (còn được gọi là nucleosome, cơ quan nhân polyprotein). POD được phát hiện trong nhân, với số lượng 15-20. Chức năng của PML vẫn chưa được làm sáng tỏ đầy đủ. Các nghiên cứu gần đây tin rằng PML có hoạt tính ức chế sự phát triển của khối u thông qua quá trình đồng hoạt hóa phiên mã. PML cũng có thể đóng một vai trò quan trọng trong nhiều con đường apoptosis. Trong M3 AML (bệnh bạch cầu nguyên bào cấp tính), RARα trên nhiễm sắc thể 17 và PML trên nhiễm sắc thể 15 chuyển vị trí cho nhau, nghĩa là, t (15; 17) (q22; q21) xảy ra. Sự chuyển vị lẫn nhau của PML và RARα gây ra những hậu quả sau: ① Protein dung hợp PML-RARα ức chế sự phân hóa và trưởng thành của tế bào sinh dục thông qua sự ức chế âm tính trội; Cấu trúc của POD bị phá hủy, và chức năng bình thường của PML ức chế sự tăng sinh và thúc đẩy quá trình apoptosis, dẫn đến tăng sinh tế bào và giảm quá trình apoptosis; ③RARα có thể liên kết với phức hợp đồng ức chế phiên mã (N-CoR / Sin3a / HDAC-1) (N-CoR = chất đồng ức chế thụ thể hạt nhân, HDAC = histone deacetylase) khi nó bình thường. Dưới tác dụng của liều sinh lý của tretinoin, RARα có thể phân ly khỏi phức hợp đồng ức chế và có vai trò kích hoạt phiên mã, tức là kích hoạt gen đích điều hòa. PML-RARα có thể thúc đẩy sự kết hợp của RARα và phức hợp đồng ức chế, ức chế các gen đích do RARα điều hòa, ức chế sự biệt hóa và trưởng thành của các tế bào tiền bào, và làm cho chúng tăng sinh, gây ra M3 AML. Ở liều điều trị, ATRA có thể làm suy giảm PML-RARα. Ngoài ra, ATRA có thể tách các phức hợp đồng ức chế khỏi RARα, do đó tuyển chọn các phức hợp chất đông tụ, bao gồm CBP / P300, P / CAF, NcoA-1 / SRC-1, P / CIF và các protein khác, trong đó CBF / P300 và P / CAF có hoạt tính acetylase histone mạnh để acetylate hóa histone. Sau khi acetyl hóa histone, chức năng của các gen mục tiêu được phiên mã được kích hoạt được phục hồi, và các tế bào tiền nhân được biệt hóa và trưởng thành.
1% ~ 2% APL có biến thể t (11; 17) (q23; q21), hợp nhất gen ngón tay kẽm của bệnh bạch cầu promyelocytic (PLZF) trên nhiễm sắc thể 11 với gen RARα trên nhiễm sắc thể 17 . Tất cả các bệnh nhân được báo cáo cho đến nay đều biểu hiện đồng thời cả hai protein dung hợp PLZF-RARα và RARα-PLZF, cho thấy rằng cơ chế bệnh sinh của t (11; 17) (q23; q21) APL có thể yêu cầu protein dung hợp RARot-PLZF đóng một vai trò tương ứng. t (11; 17) (q23; q21) APL không nhạy cảm với ATRA. Chuyển đoạn nhiễm sắc thể biến thể hiếm hơn bao gồm t (5; 17) (q35; q21) dẫn đến sự hợp nhất của gen NPM (nucleophosmin) và RARα; t (11; 17) (q13; q21) tạo ra gen dung hợp NuMA-RARα; nhân đôi ( 17) (q21.3-q23) Sản xuất gen dung hợp STATSb-RARα. Bệnh nhân với hai lần chuyển vị đầu tiên nhạy cảm với ATRA, nhưng ATRA không hiệu quả đối với bệnh nhân có gen dung hợp STAT5b-RARα dương tính.
Hiệu quả bệnh bạch cầu của gen dung hợp APL đã được xác nhận trong các mô hình động vật chuyển gen. Chuột chuyển gen hCG-PML-RARα biểu hiện PML-RARα dưới sự điều chỉnh của vi gen hMRP8 hoặc cathepsin G (human cathepsin G) phát triển bệnh bạch cầu giống APL khoảng 1 năm sau khi sinh, trong khi chuột chuyển gen hCG-PLZF-RARα được sinh ra Sau 3 đến 12 tháng, các tổn thương giống bệnh bạch cầu mãn tính dòng tủy xảy ra với sự gia tăng các tế bào promyelocytic trong tủy xương; chuột chuyển gen biểu hiện PLZF-RARα và RARα-PLZF đồng thời phát triển APL giống người; chuột chuyển gen NPM-RARα APL điển hình hoặc tổn thương giống bệnh bạch cầu mãn tính dòng tủy xuất hiện 1 năm sau khi sinh.
Các triệu chứng thường gặp: yếu tay chân, lách to, thiếu máu, gan to, sưng hạch nách, nổi hạch, tăng bạch cầu, chân tay mềm.
Các biểu hiện lâm sàng của bệnh bạch cầu nguyên bào cấp tính là các biểu hiện bình thường liên quan đến suy tạo máu của tủy xương, chẳng hạn như thiếu máu , chảy máu, nhiễm trùng; các biểu hiện liên quan đến sự xâm nhập của các tế bào bệnh bạch cầu, chẳng hạn như gan và lá lách và to hạch bạch huyết , đau xương, v.v. Ngoài các biểu hiện bệnh bạch cầu chung của các bệnh bạch cầu này, khuynh hướng chảy máu là đặc điểm lâm sàng chính của nó. 10% -20% bệnh nhân tử vong do chảy máu sớm và tỷ lệ đông máu lan tỏa trong lòng mạch (DIC) cao, khoảng 60% bệnh nhân DIC xảy ra.
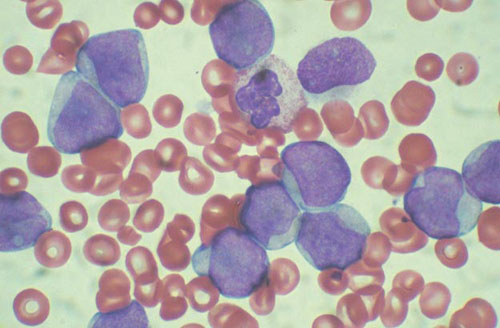
Chẩn đoán được thiết lập theo tiêu chuẩn chẩn đoán hình thái của FAB. Theo phân loại của FAB, bệnh bạch cầu nguyên bào cấp tính (cấp tính bệnh bạch cầu nguyên bào nuôi, APL) còn được gọi là loại AML-M3. Các đặc điểm điển hình của nó là: ① Hình thái tuỷ xương là sự tăng sinh bất thường của tế bào nguyên bào với tế bào chất chứa các hạt thô và tiểu thể Auer (cũng có các biến thể hạt vi mô); ② Thường xảy ra chảy máu hình nón và dễ hợp nhất với DIC và tiêu sợi huyết; ③90 % Bệnh nhân có biểu hiện ngoài tử cung nhiễm sắc thể đặc hiệu (15; 17); ④ Nhạy cảm với hóa chất (tỷ lệ kháng hóa trị <5%), thời gian sống thuyên giảm lâu, nhưng tử vong sớm cao.

Các hạng mục kiểm tra: xét nghiệm máu thường quy, chụp tủy xương, xét nghiệm miễn dịch tế bào, thời gian đông máu, xét nghiệm đông máu protamine trong huyết tương (xét nghiệm 3p), fibrinogen (Fg, FIB), plasminogen, hoạt tính plasminogen (PLG) , A), thời gian thromboplastin từng phần được kích hoạt (APTT), thời gian prothrombin (PT), sáu xét nghiệm sinh hóa máu, xét nghiệm điện giải máu
1. Hình ảnh máu điển hình của máu ngoại vi cho thấy thiếu máu , thay đổi số lượng bạch cầu, có thể thấy các tế bào chưa trưởng thành và giảm tiểu cầu .
2. Hình ảnh tuỷ xương chủ yếu là tăng sinh nguyên bào nuôi tăng sinh hạt bất thường> 30%, đa số> 50%, hình thái tế bào nhất quán hơn, có ít tế bào từng giai đoạn dưới tế bào gốc, nhân không đều hơn, có huyết tương trong và ngoài. Không có hạt nào ở lớp bùn bên ngoài và có những hạt có kích thước không đồng đều ở lớp bùn bên trong. Theo kích thước của các hạt có thể được chia thành:
M3a (loại hạt thô): Tế bào chất chứa đầy các hạt thô màu xanh anilin, chúng hợp nhất và phân bố dày đặc, các hạt cũng có thể bao phủ trường.
M3b (loại hạt mịn): Các hạt màu xanh anilin trong tế bào chất rất mịn và phân bố dày đặc.
3. Xét nghiệm miễn dịch tế bào nhãn protein CD33,13 (HLA-Dr âm tính).
4. bất thường nhiễm sắc thể di truyền tế bào , t (15; 17) ( q22; q21).
5. Thời gian đông máu, xét nghiệm 3P, hàm lượng fibrinogen, hàm lượng và hoạt tính plasminogen, ATPP (thời gian thromboplastin một phần được kích hoạt), PT (thời gian prothrombin).
6. Xét nghiệm sinh hóa và điện giải, xét nghiệm chức năng gan thận.
Tùy theo tình trạng bệnh, các biểu hiện lâm sàng, triệu chứng và dấu hiệu, chụp X-quang, CT, MRI, siêu âm B, điện tâm đồ và các xét nghiệm khác được lựa chọn.
1. Hội chứng rối loạn sinh tủy
Ngoài tạo máu bệnh lý, các loại RAEB và RAEB-t của bệnh này có các tế bào nguyên thủy và các tế bào chưa trưởng thành, pancytopenia và bất thường nhiễm sắc thể , và dễ dàng bị nhầm lẫn với bệnh bạch cầu. Nhưng các tế bào blast trong tủy xương là ít hơn 20%. Nếu các tế bào ban đầu nhiều hơn 20%, nó được phân loại là bệnh bạch cầu cấp tính.
2. Các tế bào bạch cầu bất thường do một số bệnh nhiễm trùng gây ra
Như bệnh tăng bạch cầu đơn nhân nhiễm khuẩn , trên hình máu xuất hiện tế bào lympho bất thường nhưng hình thái khác với tế bào ban đầu, diễn biến bệnh ngắn và có thể tự lành. Trong các đợt nhiễm siêu vi như ho gà , bệnh truyền nhiễm tế bào lympho, và bệnh rubella , hình ảnh máu có nhiều tế bào lympho hơn, nhưng các tế bào lympho này có hình dạng bình thường và diễn biến bệnh tốt, không có hiện tượng tăng nổ tủy xương.
3. Thiếu máu nguyên bào khổng lồ
Megalophobia đôi khi bị nhầm lẫn với bệnh bạch cầu hồng cầu (M6). Trước đây không làm tăng số lượng tế bào blast trong tủy xương, và phản ứng PAS của các tế bào hồng cầu chưa trưởng thành thường âm tính, và axit folic và vitamin B12 có hiệu quả trong điều trị.
4. Thời kỳ hồi phục của chứng mất bạch cầu hạt cấp tính
Trong thời kỳ phục hồi chứng mất bạch cầu hạt do thuốc hoặc một số bệnh nhiễm trùng , có nhiều tế bào nguyên thủy và chưa trưởng thành trong tủy xương. Tuy nhiên, căn bệnh này có nguyên nhân rõ ràng, tiểu cầu vẫn bình thường, không có Auer và bất thường nhiễm sắc thể trong tế bào nhân sơ. Các bạch cầu hạt trưởng thành trong tủy xương trở lại bình thường trong thời gian ngắn.
1. Nhiễm trùng là các biến chứng phổ biến nhất bao gồm nhiễm trùng do vi khuẩn, vi rút và nấm . Các biểu hiện chính là sốt . Các bộ phận bị nhiễm rất phổ biến trong miệng, phổi và da. Trong trường hợp nặng, nhiễm trùng huyết và sốc nhiễm độc có thể xảy ra .
2. DIC là biến chứng quan trọng nhất của APL, với tỷ lệ cao khoảng 60% bệnh nhân. Trong những năm gần đây, với việc áp dụng axit formic và asen, sự xuất hiện của DIC đã giảm đáng kể.
3. Hội chứng tăng bạch cầu và tretinoin có thể kết hợp trong quá trình sử dụng tretinoin. Có thể điều trị bằng hydroxyurea, Ara-C liều thấp hoặc giảm liều AA và DA.
Xem thêm:
Bệnh bạch cầu bẩm sinh nguyên nhân như thế nào? Thông tin chung về bệnh
Bệnh bạch cầu cấp ở người già nguyên nhân như thế nào? Thông tin chung
Bệnh bạch cầu lymphocytic mãn tính gây ra như thế nào? 4 Cách điều trị
1 Không tiếp xúc quá nhiều với tia X và các bức xạ có hại khác. Nhân viên làm công việc chụp X quang nên có biện pháp bảo vệ cá nhân và tăng cường các biện pháp phòng ngừa. Trẻ sơ sinh và phụ nữ mang thai nhạy cảm hơn với bức xạ và dễ bị tổn thương, phụ nữ nên tránh tiếp xúc với quá nhiều bức xạ trong thai kỳ , nếu không tỷ lệ mắc bệnh bạch cầu ở thai nhi sẽ cao hơn. Tuy nhiên, kiểm tra bằng tia X y tế không thường xuyên có liều lượng tương đối nhỏ và về cơ bản sẽ không ảnh hưởng đến cơ thể.
2Đừng lạm dụng thuốc. Khi sử dụng cloramphenicol, thuốc chống ung thư, thuốc ức chế miễn dịch và các thuốc khác phải thận trọng và phải có sự hướng dẫn của bác sĩ, không được tự ý sử dụng hoặc lạm dụng trong thời gian dài.
3 trong việc lựa chọn thực phẩm, ăn nhiều thức ăn giàu đạm, nhiều chất xơ, lượng thức ăn sốt cao , ăn nhiều rau quả tươi, kiêng đồ ăn nhiều dầu mỡ, cay lạnh, thịt và rau, tỷ lệ tốt nhất là 3: 7 . Cũng cố gắng tránh ăn quá nhiều thịt đã qua chế biến, sẽ làm tăng nguy cơ mắc bệnh bạch cầu.
4 Điều tra y tế đã phát hiện ra rằng ngộ độc benzen mãn tính chủ yếu làm tổn thương hệ thống tạo máu của con người, gây ra bệnh bạch cầu do giảm số lượng bạch cầu và tiểu cầu. Ô nhiễm benzen và ô nhiễm formaldehyde trong môi trường trong nhà do trang trí và nội thất gây ra gây hại cho sức khỏe con người. Đá tự nhiên và gạch men được sử dụng là nguyên nhân chính gây ra ô nhiễm phóng xạ radon trong môi trường trong nhà. Vì vậy, nó phải được thông gió và làm khô sau khi trang trí. Tôi đã mua một chiếc quạt lọc không khí, tôi cũng có thể mua một lượng lớn than hoạt tính, cây nhện, củ cải xanh có khả năng hấp thụ các khí độc hại như formaldehyde và benzen. Tốt nhất bạn nên đo bằng các dụng cụ chuyên nghiệp trước khi vào.
5 Ngủ quá muộn hoặc làm việc ngoài giờ thường xuyên làm tăng nguy cơ mắc bệnh bạch cầu. Tỷ lệ mắc bệnh bạch cầu tăng lên có liên quan đến việc tiếp xúc với ánh sáng vào ban đêm. Các nghiên cứu đã chỉ ra rằng những người ngủ với đèn hoặc giấc ngủ tự nhiên bị ảnh hưởng bởi ánh sáng nhân tạo có nguy cơ mắc bệnh ung thư cao hơn những người bình thường. Vào ban đêm, ánh sáng có thể phá vỡ nhịp sinh học của con người và ức chế sự bài tiết bình thường của melatonin, có liên quan đến sự phát triển của tế bào ung thư.
Vì vậy, mọi người cần chú ý nghỉ ngơi và đi ngủ theo đồng hồ sinh học, đến sáng hôm sau thì tắt đèn ngủ dậy.
1. APL là một loại bệnh bạch cầu cấp tính rất nguy hiểm và các triệu chứng chảy máu của nó rất phổ biến, với tỷ lệ mắc bệnh từ 72% đến 94%, cao hơn đáng kể so với các bệnh bạch cầu cấp tính khác, thường do máu lan tỏa trong lòng mạch (DIC) Hiệu suất, đặc biệt là DIC có thể trầm trọng hơn trong quá trình hóa trị, thường dẫn đến tử vong sớm của bệnh nhân. Bởi vì APL có bất thường nhiễm sắc thể duy nhất, tức là t (15; 17), tạo ra gen dung hợp PML-RARα và protein mã hóa của nó, cách xử lý của nó khác với các AML khác. Với sự phát triển gần đây của nghiên cứu APL, Phương pháp điều trị của nó đã trở thành một trong những ví dụ thành công nhất về điều trị bệnh bạch cầu. Ngay từ những năm 1970, rõ ràng APL rất nhạy cảm với thuốc anthracycline và hiệu quả điều trị của chỉ riêng hóa trị liệu tốt hơn các loại AML khác. Tretinoin (ATRA) Sự xuất hiện của thạch tín và thạch tín đã cải thiện đáng kể hiệu quả của APL. Trong khi tiến hành điều trị, việc điều trị hỗ trợ tích cực, bao gồm chống nhiễm trùng, truyền tiểu cầu, truyền máu, v.v. cũng rất quan trọng.
(1) Liệu pháp biệt hóa cảm ứng: Trước khi ứng dụng lâm sàng của axit retinoic (ATRA), các thí nghiệm in vitro đã xác nhận rằng axit retinoic (ATRA) có thể tạo ra sự biệt hóa của các dòng tế bào bệnh bạch cầu (như tế bào HL-60) và tế bào sơ cấp APL. Năm 1986, các học giả Trung Quốc đã sử dụng axit retinoic all-trans để tạo ra liệu pháp biệt hóa cho APL lần đầu tiên trên thế giới và đã đạt được thành công. Hiện tại, liệu pháp gây biệt hóa axit retinoic (ATRA) chủ yếu được sử dụng cho APL và đã bắt đầu thử các loại AML khác và Một số khối u đặc. Cơ chế hoạt động của axit retinoic trên tế bào khối u khác với cơ chế của thuốc hóa trị. Nó thúc đẩy sự biệt hóa của tế bào APL, điều chỉnh sự bất thường của cơ chế đông máu, tránh ức chế tủy xương và DIC do hóa trị gây ra , đồng thời làm cho việc điều trị bệnh bạch cầu trở nên quan trọng. Bước đột phá đã cải thiện đáng kể tiên lượng của APL.
①Công dụng và hiệu quả của tretinoin (ATRA):
A. Liều chung: Liều chung của tretinoin (ATRA) để điều trị APL là 45mg / (m2 · d), uống chia làm nhiều lần và quá trình điều trị là 30 đến 45 ngày. Đối với những bệnh nhân APL mới điều trị, tỷ lệ CR của tretinoin (ATRA) có thể đạt khoảng 90%.
B. Liều nhỏ: liều nhỏ axit retinoic (ATRA) 15 ~ 25mg / (m2 · d), uống chia làm nhiều lần, điều trị APL để giảm tác dụng phụ của axit retinoic, kết quả cho thấy điều trị liều thấp có thể đạt đến liều chung của CR tỷ lệ. Tuy nhiên, các báo cáo về việc giảm độc tính của tretinoin (ATRA) không nhất quán. Castaigne và cộng sự đã điều trị APL với 25mg / m2 và 15mg / m2 retinoic acid (ATRA), và nhận thấy rằng không có sự khác biệt đáng kể giữa hai nhóm về hiệu quả, kích thích tăng bạch cầu, hội chứng acid retinoic và dược động học.
②Cải thiện phương pháp điều trị trong giai đoạn khởi phát: Thông thường, nên kết hợp hóa trị trong điều trị tretinoin (ATRA) và áp dụng hóa trị khi bạch cầu tăng lên 3 × 109 / L. Điều này có thể ngăn ngừa sự xuất hiện của hội chứng tretinoin và Tăng tỷ lệ CR và kéo dài thời gian CR. Montessori báo cáo ở Trung Quốc rằng có thể an toàn để chuyển sang hóa trị liệu để điều trị APL 15 ngày sau khi dùng tretinoin (ATRA). Nghiên cứu của Nhóm Cộng tác Châu Âu trên 93 bệnh nhân có APL ban đầu với số lượng bạch cầu nhỏ hơn 5 × 109 / L cho thấy không có sự khác biệt về tỷ lệ thuyên giảm hoàn toàn trên lâm sàng của hai nhóm bệnh nhân dùng tretinoin (hóa trị sau ATRA và tretinoin (ATRA) + hóa trị) Tuy nhiên, tỷ lệ tái phát của bệnh nhân trong nhóm tretinoin (ATRA) + hóa trị trong vòng 2 năm thấp hơn đáng kể so với nhóm sau hóa trị liệu tretinoin (ATRA) đầu tiên. Điều đó cho thấy rằng việc sử dụng tretinoin (ATRA) và hóa trị cùng lúc có thể phát huy vai trò của hóa trị liệu tốt hơn vitamin A. Tác dụng bổ sung của axit A (ATRA) và giảm tỷ lệ tái phát. Nhóm cộng tác Ý đã nhận được DA 12mg / (m2 · d) cùng lúc vào ngày thứ 6 đến ngày thứ 8 của liệu pháp cảm ứng với Tretinoin (ATRA) 45mg / m2, và tỷ lệ thuyên giảm hoàn toàn cao như 92%. Ngoài ra, trong một số trường hợp, việc áp dụng ATRA đơn giản không thể kiểm soát bệnh, và cũng có thể thêm một lượng nhỏ cytarabine (Ara-C) hoặc các chương trình AA và DA giảm.
Vấn đề chính đối với những bệnh nhân sử dụng đơn lẻ liệu pháp kích thích và duy trì tretinoin (ATRA) là tái phát sớm, với thời gian CR trung bình chỉ là 5 tháng. Nguyên nhân chính dẫn đến tình trạng kháng ATRA và bệnh bạch cầu tái phát lúc này có thể là do sử dụng tretinoin (ATRA) trong thời gian dài để tạo ra enzym chuyển hóa ATRA trong huyết tương khiến nồng độ tretinoin (ATRA) trong máu giảm xuống không đủ để duy trì tế bào ung thư máu tiếp tục biệt hóa. Trưởng thành; hoặc tế bào bệnh bạch cầu tổng hợp protein liên kết ATRA dưới sự cảm ứng của axit retinoic (ATRA), do đó ngăn cản thuốc xâm nhập vào nhân để tạo ra sự biệt hóa. Nhiều tác giả đã phát hiện ra rằng ở những bệnh nhân luôn được điều trị chỉ với ATRA mà bệnh thuyên giảm, hầu hết biểu hiện gen dung hợp PML-RARα tiếp tục dương tính và biểu hiện của nó có tương quan nhiều với sự tái phát của bệnh bạch cầu. Tuy nhiên, nếu thêm hóa trị liệu, biểu hiện PML-RARα có thể chuyển sang âm tính, và thời gian sống thêm của bệnh nhân cũng kéo dài đáng kể. Do đó, mặc dù việc sử dụng điều trị bằng tretinoin (ATRA) đã đạt được tỷ lệ CR cao, hóa trị liệu vẫn cần thiết để thuyên giảm lâu dài và thậm chí chữa khỏi APL.
Tuy nhiên, liệu pháp kích thích thuyên giảm với tretinoin (ATRA) cũng giúp kéo dài thời gian thuyên giảm APL. Bảng 2 tóm tắt các hiệu quả điều trị APL được các tác giả nước ngoài báo cáo: bệnh nhân được điều trị bằng tretinoin (ATRA) ± hóa trị sau khi thuyên giảm, và hóa trị được sử dụng để củng cố và tăng cường sau khi thuyên giảm. Nhóm hóa trị (ATRA) + tốt hơn đáng kể so với nhóm hóa trị sử dụng một lần trong cùng thời kỳ hoặc nhóm chứng trước đây. Điều này cho thấy tretinoin (ATRA) có thể làm tăng độ nhạy của APL với hóa trị và giảm đáng kể sự tái phát của bệnh.
③ Điều trị sau khi thuyên giảm: Tretinoin (ATRA) kết hợp với hóa trị có thể cải thiện đáng kể tiên lượng của bệnh nhân. Một nghiên cứu hồi cứu của Viện Huyết học Thượng Hải trên một nhóm (70 trường hợp) với DA hoặc HA, tretinoin (ATRA), mercaptopurine (6-MP) + methotrexate (MTX) điều trị tuần tự cho thấy trung bình 5 Tỷ lệ sống sạch bệnh hàng năm là 70% ± 6%. Một nghiên cứu hồi cứu khác cho thấy tỷ lệ sống không bệnh sau 5 năm của 64 bệnh nhân sử dụng kết hợp tretinoin (ATRA) và hóa trị là 58,5% ± 10,4%, trong khi nhóm còn lại (47 bệnh nhân) chỉ được hóa trị 26,7 bệnh nhân. % ± 9,4%. Nghiên cứu tiền cứu được thực hiện bởi Tallman và cộng sự cũng khẳng định điểm này, đó là những trường hợp sử dụng tretinoin (ATRA) để vừa cảm ứng thuyên giảm vừa tăng cường củng cố có hiệu quả tốt hơn so với những trường hợp chỉ dùng hóa trị liệu. Trên cơ sở phòng ngừa hiệu quả hội chứng AT-RA, kết hợp với hóa trị, 90% người khởi phát bệnh lần đầu thuyên giảm, trong khi chỉ riêng hóa trị liệu tỷ lệ thuyên giảm bệnh khó đạt 80% ngay cả ở người khởi phát lần đầu. France Fenaux và cộng sự đã báo cáo rằng một nhóm 54 trường hợp APL được điều trị bằng tretinoin (ATRA), với tỷ lệ CR là 90% và sau đó được củng cố bằng hóa trị liệu chuyên sâu. Tỷ lệ sống sót sau 2 năm không có biến cố (EFS) là 68% và tỷ lệ sống sót là 81%. Năm 1995, Nhóm nghiên cứu bệnh bạch cầu người lớn Nhật Bản báo cáo 109 trường hợp APL. Sau khi CR (89%) đạt được bằng cách sử dụng tretinoin (ATRA) hoặc tretinoin (ATRA) cộng với hóa trị (89%), hóa trị được sử dụng để củng cố EFS ở tháng thứ 23 là 75% ( 66% ~ 83%), DFS cho CR là 81% (71% ~ 91%). Thông thường người ta ủng hộ rằng nên sử dụng xen kẽ hóa trị và tretinoin sau khi bệnh thuyên giảm.
Điều trị biến thể ④APL: Ngoài chuyển vị t (15; 17) điển hình, còn có một biến thể hiếm gặp t (11; 17) (q23; q21), chiếm 1% APL. % ~ 2%, nó làm cho RARα và một yếu tố phiên mã PLZF (promyelocytic bệnh bạch cầu zincfinger) phản ứng tổng hợp gen . Bệnh nhân t (11; 17) đáp ứng kém hoặc không hiệu quả với liệu pháp biệt hóa gây ra bởi ATRA hoặc hóa trị, và các tế bào bệnh bạch cầu của họ không biệt hóa sau khi điều trị ATRA khi chúng được nuôi cấy trong ống nghiệm. Những bệnh nhân như vậy có hiệu quả khi điều trị tretinoin (ATRA) + G-CSF hoặc tretinoin (ATRA) + hóa trị; biến thể khác chuyển vị t (11; 17) (q13; q11) có ít tỷ lệ mắc hơn và có liên quan Gen dung hợp là NuMA-RARα, loại điều trị ATRA này có hiệu quả. Một biến thể khác của chuyển vị M3 t (5; 17) (q32; q21) liên quan đến gen nucleophosmin (NPM) trên nhiễm sắc thể số 5. Sự hình thành gen dung hợp NPM-RARα, những bệnh nhân như vậy điều trị bằng tretinoin (ATRA) có hiệu quả.
Tác dụng phụ của ⑤Tretinoin (ATRA): bao gồm khô môi và da (70% ~ 90%), nhức đầu (25% ~ 40%), đau xương và khớp (15% ~ 30%), tổn thương chức năng gan và lipid máu Tăng (12% -30%), v.v. 2/3 đến 3/4 bệnh nhân có mức độ tăng bạch cầu khác nhau. Các biến chứng nghiêm trọng nhất là hội chứng tretinoin và huyết khối. Biểu hiện trước đây là sốt , tức ngực, khó thở , giữ nước kèm theo phù nề , tràn dịch màng phổi hoặc màng tim , tăng huyết áp, suy hô hấp, thiếu oxy, suy hô hấp và một số ít suy thận. Nó thường xảy ra ở những bệnh nhân có lượng bạch cầu cao, với tỷ lệ mắc bệnh từ 10% đến 25%, là nguyên nhân gây tử vong. Sau khi hóa trị kết hợp, biến chứng nghiêm trọng này đã giảm xuống còn 5% đến 7%. Phương pháp điều trị là tiêm tĩnh mạch dexamethason liều cao, 10 mg / lần, 2 lần / ngày, tổng cộng từ 3 đến 5 ngày.
⑥ Cơ chế điều trị: Cơ chế của Tretinoin (ATRA) tạo ra sự khác biệt để điều trị APL vẫn chưa được làm sáng tỏ đầy đủ. Do sự phát hiện ra các thụ thể α, β và γ của tretinoin (ATRA) và việc làm sáng tỏ thêm về cấu trúc và chức năng của chúng, nghiên cứu về cơ chế của tretinoin (ATRA) đã được phát triển rất nhiều. Theo các dữ liệu hiện có và kết quả nghiên cứu trong nước, có thể tóm tắt như sau: Tretinoin (ATRA) thay đổi đặc tính sinh học của tế bào APL đồng thời gây biệt hóa và giảm tác dụng ức chế của nó đối với tế bào tạo máu của tủy xương; dung hợp đặc hiệu APL Protein PML / RARα bị phân hủy dưới tác động của ATRA, sự phân bố PML trở lại bình thường, các chức năng bình thường của RARα, RARX và sự biệt hóa của các tế bào tiền bào do PML / RARα ức chế ban đầu được phục hồi; tretinoin (ATRA) thúc đẩy quá trình tự chết của tế bào APL ; Tretinoin (ATRA) điều chỉnh các protein và gen sau, RARα, RARβ, IRF-2, STATla, STATlb, STAT2, RIG-E, F, G, H, I, IL-lb, G-CSF receptor, GM Thụ thể -CSF, CD11c, CD11b, CDl5, CD18, CD45RO, protein kinase C, glutamyltransferase của mô, ornithine decarboxylase, phosphatase kiềm, chất kích hoạt plasminogen loại urokinase, MCP-1 , IFN-α, chất ức chế hoạt hóa plasmin (PAI). Ngược lại, aATRA điều chỉnh giảm các protein và gen sau: yếu tố mô, chất thúc đẩy khối u, yếu tố mô liên kết VIII, C-MYC, CD33, hoạt động của telomerase, BCL-2, PARP (poly ADP ribose polymerase), độ đàn hồi của mô Enzyme G, elastase, myeloperoxidase, kháng nguyên CD45RA. Có thể thấy rằng vai trò của axit retinoic (ATRA) liên quan đến một phạm vi rộng, và một số ảnh hưởng trực tiếp đến sự liên kết và vai trò của axit retinoic (ATRA), chẳng hạn như liên kết với RARα; một số liên quan đến chức năng của tế bào promyelocytic, chẳng hạn như một số Những thay đổi về enzym; một số liên quan đến quá trình đông máu, chẳng hạn như sự điều chỉnh giảm của yếu tố mô và máy gia tốc khối u, điều này có thể giải thích tại sao DIC cải thiện trong quá trình biệt hóa gây ra bởi tretinoin (ATRA); một số gen có liên quan chặt chẽ đến việc truyền tín hiệu, chẳng hạn như STAT, PKC; Nhiều thay đổi về gen có thể làm rõ tác dụng ủng hộ quá trình chết của tretinoin (ATRA), chẳng hạn như sự giảm BCL-2 và PARP. Việc điều hòa các thụ thể G-CSF và GM-CSF có thể giải thích sự gia tăng của các tế bào bạch cầu trong quá trình điều trị tretinoin (ATRA). Viện Huyết học Thượng Hải phát hiện ra rằng một số gen (RIG-E, F, G, H, I) được điều chỉnh bởi tretinoin (ATRA), mặc dù các đặc tính của chúng đã được làm rõ ban đầu, chẳng hạn như RIG-G và kích thích interferon Một họ gen (ISG) có độ tương đồng cao và cùng vị trí nhiễm sắc thể. RIG-E có độ tương đồng nhất định với các thụ thể nhất định như EGFR (thụ thể yếu tố tăng trưởng biểu mô), LDL-R, uPAR, v.v. Tuy nhiên, cơ chế chính xác của chúng trong việc điều trị APL bằng axit retinoic (ATRA) vẫn chưa được làm sáng tỏ thêm.
(2) Xử lý asen:
① Cảm ứng thuyên giảm: Tretinoin (ATRA) có thể đạt tỷ lệ thuyên giảm cao trong điều trị APL mới điều trị, nhưng hầu hết các trường hợp dễ bị kháng thuốc, sau khi tái phát, điều trị bằng tretinoin (ATRA) ít hiệu quả hơn. Từ đầu những năm 1970, Đại học Y khoa Cáp Nhĩ Tân đã sử dụng “Bệnh số 1” với asen là thành phần chính để điều trị APL và đã đạt được kết quả tốt. Kế hoạch điều trị kích thích cắt cơn: Người lớn tiêm As2O3 0,1% 10ml / ngày, 250 ~ 500ml dung dịch glucose 5%, nhỏ giọt tĩnh mạch trong 3 ~ 4 giờ, trẻ em có thể đo liều 6mg / m2, 4 tuần là một đợt điều trị, mỗi đợt điều trị Có thể dùng ngắt quãng từ 5 đến 7 ngày hoặc dùng thuốc liên tục, hết 2 đợt điều trị nếu tình trạng bệnh không thuyên giảm.
Năm 1995, Huang Shilin và cộng sự đã báo cáo kết quả ứng dụng viên nén Qingdai hợp chất thảo dược Trung Quốc có chứa asen sulfhydryl trong điều trị APL ban đầu. Phương án cụ thể như sau: viên Indigo Naturalis dạng viên uống, ngày 15 viên (0,25g / viên), tăng dần lên 30 viên mỗi ngày sau một tuần, dùng thuốc liên tục từ 30 đến 60 ngày, tỷ lệ CR có thể đạt 98,3%. Từ tháng 2 năm 1998, Lu Daopei và những người khác đã sử dụng As4S4 (TATS) có độ tinh khiết trung bình để điều trị APL. Phương pháp là: uống 0,5g, 3 lần một ngày, trong 2 đến 4 tuần, nghỉ 2 đến 3 tuần, tổng cộng là 3 đến 4 năm. Sau đó, ứng dụng lâm sàng của TATS độ tinh khiết cao được thực hiện, phương pháp là: 1g, 3 lần / ngày, cho đến khi CR, nghỉ từ 2 đến 3 tuần. Khoảng thời gian nghỉ ngơi trong năm thứ tư có thể được kéo dài đến 4-6 tuần. Sau khi áp dụng TATS, nồng độ asen trong huyết tương đạt đỉnh (40 ~ 104mcg / L) vào ngày thứ 15, và nồng độ asen trong huyết tương giảm xuống <2 ~ 22mcg / L (trung bình 15mcg / L) sau 2 tuần ngừng sử dụng. 30 ngày sau khi ngừng, mức trung bình Nồng độ trong huyết tương là 3mcg / L. Hiệu quả của thạch tín trong điều trị APL mới điều trị, tái phát và chịu lửa.
A. Chỉ định As2O3 để điều trị APL: a. APL mới được điều trị, đặc biệt là những gen có t (15; 17) dương tính hoặc gen dung hợp PML-RARα. b. Tretinoin (ATRA) hoặc điều trị hóa trị liệu kết hợp là APL khó chữa hoặc tái phát. c. APL không thể dung nạp hoặc không nên sử dụng tretinoin (ATRA) hoặc hóa trị liệu kết hợp. d. Điều trị củng cố và duy trì sau APL CR. e. Các loại bệnh bạch cầu khác (bệnh bạch cầu dòng tủy mãn tính, ANLL M2, M4, M6) và MDS với sự gia tăng promyelocytic bất thường.
Không nên sử dụng APL được điều trị bằng As203: những người bị rối loạn chức năng gan và thận nặng không phải do bệnh bạch cầu gây ra; những người bị tái phát điều trị củng cố As2O3; những người có biểu hiện ngộ độc asen .
B. độc tính: Độc cấp tính gây ứ dịch chính (tràn dịch màng phổi, tràn dịch màng tim, tăng cân ), sử dụng thuốc lợi tiểu ngắn hạn có hiệu quả, dexamethasone không có tác dụng đáng kể. Khoảng 20% bệnh nhân có thể có các phản ứng tiêu hóa, biểu hiện là buồn nôn, nôn , đau bụng, tiêu chảy, chán ăn và 10% bệnh nhân bị tê tay chân ở các mức độ khác nhau và phù mặt. 20% đến 30% bệnh nhân dùng liều thông thường có thể có chức năng thận bất thường ở các mức độ khác nhau, nhưng hầu hết họ trở lại bình thường từ 1 đến 2 tuần sau khi ngừng thuốc. Đối với gan, trong những trường hợp ban đầu của bệnh viêm gan mãn tính sẽ dễ dẫn đến hoại tử tế bào gan và gây suy gan. Điện tâm đồ có thể cho thấy nhịp tim nhanh xoang, blốc nhĩ thất mức độ từ đến block, blốc nhĩ thất hoàn toàn và các rối loạn nhịp thất khác nhau . Cần phải chỉ ra rằng trong quá trình điều trị asen, 2/3 số bệnh nhân có bạch cầu tăng cao và 10% -15% bệnh nhân có hội chứng tretinoin tương tự. Các biểu hiện lâm sàng và điều trị giống như những biểu hiện xảy ra trong điều trị tretinoin. Một số bệnh nhân có các tác dụng phụ mãn tính, chẳng hạn như sắc tố da, dày sừng lòng bàn tay, viêm đa dây thần kinh (suy giảm chức năng thần kinh cảm giác và vận động), và teo cơ. Khi liều> 0,2mg / (kg · d), có thể xảy ra các tác dụng phụ nghiêm trọng như tê liệt và suy thận. Nhiễm độc As203 mãn tính không chỉ phụ thuộc vào số lượng sử dụng, mà còn phụ thuộc vào tính nhạy cảm của từng người. Khi bị ngộ độc asen nghiêm trọng, có thể sử dụng các loại thuốc để giảm tác dụng phụ của nó, chẳng hạn như natri dimercaptopropane sulfonate (2,3-dimercaptopropane sulfonate).
C. Cơ chế xử lý asen của APL: về mặt hình thái có thể thấy chất nhiễm sắc thể pyknosis của nhân tạo thành thể apoptotic. Các nghiên cứu trong ống nghiệm đã phát hiện ra rằng nồng độ asen thấp (0,1μmol / L) có thể tạo ra sự biệt hóa của các tế bào NB4. Ở nồng độ cao (> 0,5 ~ 1μmol / L), asen gây ra apoptosis. Phân tích DNA, trong xét nghiệm tế bào kế dòng chảy tế bào, có thể thấy một đỉnh apoptotic trước đỉnh G1. Điện di DNA cho thấy những thay đổi bậc thang apoptotic điển hình. Kết quả nghiên cứu tế bào và sinh học phân tử cho thấy As2O3 có thể phân hủy protein dung hợp PML / RARα, điều hòa gen BCL-2, và không ảnh hưởng đến gen BAX. Các kết quả trên gợi ý rằng cơ chế của As2O3 trong điều trị APL có thể chủ yếu là gây ra quá trình apoptosis của tế bào APL và tạo ra sự biệt hóa ở nồng độ thấp. Ngoài ra, một số cơ chế phân tử trong hoạt động của asen bao gồm:
a. Kênh tín hiệu protein kinase (cMAPK) được kích hoạt mitogen và JNK / SAPK liên quan đến stress (protease kích hoạt căng thẳng) và P38 kinase được kích hoạt, dẫn đến quá trình chết rụng.
b. Asen làm tăng tính thấm của các lỗ PT (thay đổi tính thấm) trên màng ti thể, gây giải phóng AIF và cytochrom C bên trong ti thể ra bên ngoài ti thể.
c. Nó hoạt động trên G1 / S và G2 / M và kéo dài chu kỳ tế bào.
d. Asen hóa trị ba có thể gây ra những thay đổi trong hoạt động của ornithine decarboxylase (ODC) trong các tế bào bệnh bạch cầu, ảnh hưởng đến sự tổng hợp polyamine và ức chế sự phát triển của khối u.
② Điều trị asen sau khi bệnh thuyên giảm hoàn toàn APL: liều As2O3 thường xuyên được sử dụng trong 2 đến 3 tuần cho mỗi đợt điều trị. Thời gian ngắt quãng của việc sử dụng As2O3 là 1, 2, 3, 4 và 6 tháng sau CR lần lượt là 1, 2, 3 và 3 năm ; Ngoài ra, As203 và hóa trị kết hợp (HA, DA hoặc Am-C + mitoxantrone (NVT) / etoposide (VP-16) có thể được thực hiện luân phiên, thời gian ngắt quãng giống như trên.
(3) ATBA kết hợp với As203 trong điều trị APL: Tretinoin (ATRA) có thể đạt được tỷ lệ thuyên giảm hoàn toàn (CR) từ 80% đến 90% trong điều trị APL. So với các thuốc gây độc tế bào điển hình, tretinoin (ATRA) có thể cải thiện APL Tình trạng rối loạn đông máu của bệnh nhân không gây ức chế tủy xương. Tuy nhiên, tretinoin (ATRA) có thể gây ra các hội chứng tử vong do thuốc. Đồng thời, điều trị duy trì bằng tretinoin (ATRA) đơn thuần thường gây tái phát bệnh bạch cầu nên hạn chế áp dụng. As203 không chỉ có thể gây ra CR trong APL mới được điều trị, mà còn gây ra 90% CR ở những bệnh nhân tái phát sau khi điều trị bằng thuốc độc tế bào và tretinoin (ATRA). Các thí nghiệm trong ống nghiệm đã chỉ ra rằng cơ chế của As2O3 khác với cơ chế của tretinoin (ATRA) và có thể khiến các tế bào bệnh bạch cầu trải qua quá trình apoptosis. Các nghiên cứu về tác dụng của tretinoin (ATRA) kết hợp với As203 trên dòng tế bào APL và tế bào APL tươi đã chỉ ra rằng sự kết hợp của hai loại thuốc có tác dụng hiệp đồng đối với sự biệt hóa và cũng có thể thúc đẩy sự nhạy cảm của các tế bào kháng thuốc với thuốc. Viện Huyết học Thượng Hải áp dụng Tretinoin (ATRA) 25mg / (m2 · d), As203 0,16mg / (kg · d), kết hợp điều trị APL ban đầu cho đến khi CR. Kết quả cho thấy 2 trong số 31 bệnh nhân tử vong sớm, 29 bệnh nhân bị CRT, tỷ lệ CR là 93,5%, thời gian đạt CR trung bình (25,1 ± 3,9) ngày, 66,5% bệnh nhân tăng bạch cầu sau điều trị và 65,5% có chức năng gan. Bất thường, nhưng liều sẽ giảm hoặc ngừng trong vòng 1 tuần. Ở CR, 10,3% PML / RARα trở nên âm tính và 77,0% trở nên âm tính sau khi điều trị củng cố.
(4) Ghép tế bào gốc tạo máu (HSCT): Những bệnh nhân mới được chẩn đoán được điều trị bằng tretinoin (ATRA) kết hợp với hóa trị, CR có thể đạt 70% đến 80%. Và hầu hết bệnh nhân sử dụng As203 hoặc bôi lại tretinoin (ATRA) và hóa trị sau lần tái phát đầu tiên cũng có thể có tỷ lệ thuyên giảm lần thứ hai cao hơn (CR2). Do đó, người ta thường tin rằng điều trị HSCT không được khuyến cáo cho bệnh nhân thuyên giảm lần đầu. . Mặc dù các phương pháp điều trị hiện nay có thể đạt tỷ lệ thuyên giảm APL cao hơn nhưng tỷ lệ tái phát vẫn lên tới 25%. Ghép tế bào gốc tự thân hoặc dị nguyên có thể là phương pháp điều trị cứu cánh cho những bệnh nhân này. Trước khi áp dụng lâm sàng tretinoin (ATRA), HSCT có thể chữa khỏi 45% bệnh nhân thuyên giảm thứ phát. Các nghiên cứu gần đây cho thấy việc áp dụng phương pháp cấy ghép tự thân sau khi thuyên giảm lần 2 rất hiệu quả, có thể giảm tái phát ung thư máu, khiến tỷ lệ sống không bệnh vượt quá 70%. Các báo cáo trong và ngoài nước cho thấy DFS 3 năm sau CR là 77% đến 80%, tốt hơn so với phương án điều trị sau CR bằng hóa trị đơn độc hoặc hóa trị kết hợp tretinoin (ATRA). Theo quan điểm của việc sử dụng hóa trị, tretinoin và asen ở những bệnh nhân thuyên giảm APL, tỷ lệ sống sót sau 5 năm có thể đạt 50% đến 70%, và xem xét tỷ lệ tử vong liên quan đến điều trị, điều trị HSCT không nhất thiết phải thực hiện sau đợt thuyên giảm hoàn toàn đầu tiên của bệnh. Nó chủ yếu thích hợp cho những bệnh nhân bị tái phát hoặc những bệnh nhân dương tính liên tục lâu dài của gen dung hợp PML-RARα. Tuy nhiên, bất chấp tỷ lệ tử vong liên quan đến cấy ghép từ 15% đến 20%, HSCT toàn thể vẫn là một lựa chọn điều trị quan trọng cho những bệnh nhân thuyên giảm thứ phát hoặc nhiều lần. Đối với những bệnh nhân trẻ tuổi và những người không thể đạt được sự thuyên giảm di truyền, nếu có người cho phù hợp, điều trị HSCT cũng nên được lựa chọn.
(5) Các phương pháp điều trị mới:
①Liposome tretinoin (ATRA): Hiện tại, chỉ có các chế phẩm uống được sử dụng trong tretinoin lâm sàng (ATRA). Gần đây, liposomal tretinoin (ATRA) để sử dụng trong đường tĩnh mạch đã được phát triển. Chế phẩm này thích hợp cho những bệnh nhân và trẻ em không thể nuốt hoặc hấp thu được, và có thể khắc phục được tình trạng mất ổn định nồng độ thuốc trong máu do uống ở những bệnh nhân này. Liều dung nạp tối đa của liposomal tretinoin (ATRA) là 140mg / m2, và liều 90mg / m2 có thể đạt được sự thuyên giảm một cách an toàn và hiệu quả ở những bệnh nhân bị APL ban đầu và tái phát. Vì vậy, mặc dù các chế phẩm uống dễ sử dụng, liposomal tretinoin (ATRA) vẫn có thể là một lựa chọn thay thế thuận tiện.
② Chất ức chế men deacetylase: Hoạt động phiên mã của nhiều gen được xác định bởi trạng thái acetyl hóa của histone; trạng thái acetyl hóa của histone được xác định bởi histone acetyltransferase (HATs) và histone deacetylases (HDACs). )điều chỉnh. Các chất ức chế HDAC có tác dụng thúc đẩy sự biệt hóa, chống tăng sinh và apoptosis, và chủ yếu bao gồm butyrate, trichostatin, benzamide và peptide vòng. Các thành phần này kết hợp với tretinoin (ATRA) có tác dụng chống bệnh bạch cầu rõ rệt.
③ Kháng thể đơn dòng: HuM195 là kháng thể đơn dòng kháng CD33 được nhân bản hóa, đã được sử dụng thành công trong điều trị bệnh dư thừa tối thiểu APL đã thuyên giảm về huyết học và PCR dương tính sau khi tretinoin (ATRA) và (hoặc) hóa trị. . HuM195 có thể được kết nối với 131I, 90Y và 213Bi, và hiệu quả điều trị lâm sàng của nó vẫn còn được nhìn thấy. Một kháng thể đơn dòng kháng CD33 khác được nhân bản hóa liên kết với calicheamicin (CMA676, Mylotary) đã được phát triển. Kháng thể đơn dòng này đã được FDA chấp thuận để điều trị AML tái phát. Kết quả sơ bộ cho thấy nó có thể kiểm soát phân tử Bệnh tồn lưu tối thiểu ở bệnh nhân APL với bằng chứng tái phát sinh học.
Trước đây, hiệu quả điều trị của APL kém và tình trạng bệnh nguy hiểm, với việc không ngừng nâng cao hiểu biết về đặc điểm sinh học tế bào của APL và cải tiến phương pháp điều trị, kết quả điều trị và tiên lượng đã được cải thiện đáng kể, tỷ lệ tử vong sớm đã giảm đáng kể và tiếp tục thuyên giảm Kéo dài thời gian là loại thuốc điều trị bệnh bạch cầu tốt nhất hiện nay.
Chế độ ăn uống bệnh bạch cầu promyelocytic cấp tính
Ăn những thực phẩm nào tốt cho cơ thể:
1) Nhiều protein: Bệnh bạch cầu là do sự thay đổi bệnh lý của tế bào máu, việc tiêu thụ protein trong cơ thể của những bệnh nhân này lớn hơn nhiều so với người bình thường, chỉ bằng cách bổ sung protein chất lượng cao thì các mô mới được duy trì. Chức năng của cơ quan. Một chức năng khác của protein là tạo thành kháng thể, có thể bảo vệ cơ thể khỏi vi khuẩn, vi rút và nâng cao sức đề kháng của cơ thể. Vì vậy, bệnh nhân ung thư máu nên thực hiện chế độ ăn giàu đạm, đặc biệt là những thực phẩm có chất lượng tốt, tỷ lệ tiêu hóa và hấp thu đạm thực vật và đạm họ đậu cao như đậu hũ, đậu hũ, đậu hũ khô, yuba, sữa đậu nành, v.v. Để bổ sung lượng protein cần thiết cho cơ thể.
Protein của cơ thể người có chức năng điều hòa sự cân bằng axit-bazơ của cơ thể người, nếu thiếu protein trong cơ thể người, sự mất cân bằng axit-bazơ của dịch cơ thể sẽ làm cho môi trường kiềm yếu của cơ thể trở thành axit, dẫn đến các bệnh nội sinh của cơ thể người, trong đó có ung thư. đã xảy ra.
2). Ăn nhiều thực phẩm giàu vitamin: dữ liệu lâm sàng chứng minh,Khoảng 70 đến 90% bệnh nhân có khối u ác tính có mức độ thiếu vitamin khác nhau . Nghiên cứu y học nước ngoài chứng minh rằng ăn nhiều rau và trái cây giàu vitamin C có thể ngăn chặn tế bào ung thư hình thành và lây lan. Uống nhiều vitamin C cũng có thể tăng cường sức đề kháng cục bộ của cơ thể và chức năng miễn dịch hệ thống, để đạt được mục đích kiểm soát và chữa khỏi ung thư. Thực phẩm giàu vitamin C bao gồm hạt cải dầu, mù tạt potherb, cà chua, lai trắng nhỏ, tỏi tây, hạt dẻ nước, táo gai, cam quýt, chà là tươi, kiwi, hắc mai biển và chanh.
Vitamin A có thể kích thích hệ thống miễn dịch của cơ thể, huy động sự hăng hái của cơ thể để chống lại bệnh ung thư và chống lại sự xâm nhập cơ thể của các tác nhân gây bệnh. Thực phẩm giàu vitamin A bao gồm cà rốt, bí ngô, cỏ linh lăng, ớt chuông và rau bina.
Vitamin có thể được chia thành vitamin tan trong nước và tan trong chất béo, vitamin tan trong nước bao gồm VitC và vitamin B. Các vitamin tan trong chất béo bao gồm A, D, E và K. Các vitamin tan trong nước được cơ thể con người hấp thụ dễ dàng và dễ bị mất đi từ dịch cơ thể. Bổ sung không kịp thời có thể gây thiếu hụt vitamin. Các vitamin tan trong chất béo dễ tích trữ trong mô mỡ và gan, đào thải chậm qua mật nên nếu dùng quá nhiều có thể gây ngộ độc . Vitamin cho con người cần được bổ sung một cách phối hợp hợp lý, không hơn không kém, bổ sung phù hợp. Việc thiếu hụt vitamin cũng sẽ gây ra hiện tượng hình thành axit, cơ thể con người cần bổ sung các loại vitamin cần thiết từ thực vật.
3). Ăn nhiều thực phẩm giàu chất sắt: Một trong những biểu hiện chính của bệnh ung thư máu là thiếu máu, do đó, người bệnh được khuyến khích ăn các thực phẩm giàu chất sắt như đậu Hà Lan, đậu đen, rau xanh, củ kiệu. Táo tàu, đường nâu, nấm đen, vừng, lòng đỏ trứng, v.v.
Chăm sóc sức khỏe:
Ăn thành nhiều bữa nhỏ và thường xuyên, dễ tiêu hóa: Bệnh nhân ung thư máu, đặc biệt là trong quá trình điều trị, hệ tiêu hóa thường có nhiều phản ứng như buồn nôn , nôn , chướng bụng.Tiêu chảy và các triệu chứng khác. Lúc này, bạn có thể chia thành nhiều bữa nhỏ và nhiều bữa khác, hoặc bổ sung một số thực phẩm dinh dưỡng nhỏ, nhiều calo, bổ sung vào ba bữa ăn như bánh ngọt, sô cô la, bánh mì, kiwi, nước ép rau tươi, v.v. Đối với các phản ứng có hại của hệ tiêu hóa, bệnh nhân nên ăn nhiều thức ăn có tính kiềm để giảm bớt khó chịu cho đường tiêu hóa, đồng thời
điều chỉnh chế độ ăn tùy theo tình trạng: nếu bệnh nhân kém ăn, khó tiêu có thể cho ăn nửa lỏng hoặc mềm như hai bữa. Cháo gạo, sữa trứng hấp, sữa chua, đậu hũ non, bánh bao hấp,… có thể ăn kèm với táo gai, củ cải và các thức ăn tiêu hóa khác.
Tóm lại, do cơ thể chuyển hóa trong bệnh cường giáp ở bệnh nhân ung thư máu, khả năng miễn dịch thấp, nên sốt cao cần cho sốt cao, nhiều đạm, giàu vitamin, khoáng chất và chế độ ăn dễ tiêu, bổ sung nhiệt lượng cho cơ thể và tiêu thụ các chất dinh dưỡng khác nhau. Đặc biệt trong quá trình hóa trị, bệnh nhân thường có các phản ứng về đường tiêu hóa như chán ăn , chướng bụng, tiêu chảy, buồn nôn, nôn, cần chú ý đến màu sắc, mùi thơm, mùi vị, loại món ăn để khơi dậy cảm giác thèm ăn của bệnh nhân. Một loạt các phản ứng bất lợi của bệnh nhân ung thư máu trong quá trình điều trị là do dịch cơ thể có tính axit, làm tổn thương hệ tiêu hóa và hệ miễn dịch, thay đổi quá trình axit hóa dịch cơ thể, phục hồi chức năng của hệ tiêu hóa và hệ miễn dịch.