JEE Main 2021 Giải pháp giấy Hóa học TRỰC TIẾP 24-Feb Shift-1 Dựa trên bộ nhớ
Những tiến bộ trong cấu trúc nguyên tử và cơ học lượng tử đã dẫn đến việc khám phá ra các hạt cơ bản khác. Việc phát hiện ra các hạt hạ nguyên tử đã là cơ sở cho nhiều khám phá và phát minh khác.
Cấu trúc nguyên tử là gì?
Cấu trúc nguyên tử của một nguyên tố liên quan đến cấu tạo hạt nhân của nó và sự sắp xếp của các electron xung quanh nó. Về cơ bản, cấu trúc nguyên tử của vật chất được tạo thành từ các proton , electron và neutron.
Các proton và neutron tạo nên hạt nhân của nguyên tử, được bao quanh bởi các electron của nguyên tử. Số hiệu nguyên tử của một nguyên tố mô tả tổng số proton trong hạt nhân của nó.
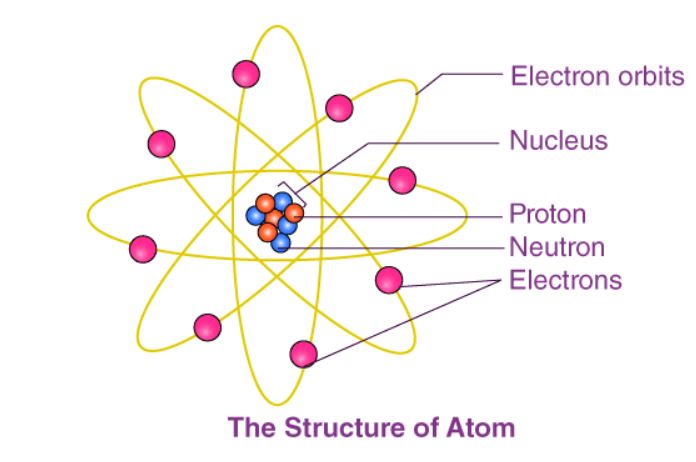

Nguyên tử trung hòa có số proton và electron bằng nhau. Tuy nhiên, các nguyên tử có thể thu được hoặc mất đi các electron để tăng tính ổn định của chúng và thực thể mang điện được gọi là ion.
Nguyên tử của các nguyên tố khác nhau có cấu trúc nguyên tử khác nhau vì chúng chứa các số proton và electron khác nhau . Đây là lý do cho các đặc điểm độc đáo của các yếu tố khác nhau.
Mô hình nguyên tử
Trong thế kỷ 18 và 19, nhiều nhà khoa học đã cố gắng giải thích cấu trúc của nguyên tử với sự trợ giúp của các mô hình nguyên tử. Mỗi mô hình này đều có những giá trị và điểm tốt riêng và đóng vai trò quan trọng trong sự phát triển của mô hình nguyên tử hiện đại . Những đóng góp đáng chú ý nhất cho lĩnh vực này là của các nhà khoa học John Dalton, JJ Thomson, Ernest Rutherford và Niels Bohr. Ý tưởng của họ về cấu trúc của nguyên tử được thảo luận trong tiểu mục này.
Lý thuyết nguyên tử của Dalton
Nhà hóa học người Anh John Dalton cho rằng mọi vật chất đều được tạo thành từ các nguyên tử, là nguyên tử không thể phân chia và không thể phá hủy được. Ông cũng tuyên bố rằng tất cả các nguyên tử của một nguyên tố hoàn toàn giống nhau, nhưng nguyên tử của các nguyên tố khác nhau thì khác nhau về kích thước và khối lượng.
Các phản ứng hóa học, theo lý thuyết nguyên tử của Dalton, liên quan đến sự sắp xếp lại các nguyên tử để tạo thành sản phẩm. Theo các định đề do Dalton đề xuất, cấu trúc nguyên tử bao gồm các nguyên tử, hạt nhỏ nhất chịu trách nhiệm cho các phản ứng hóa học xảy ra.
Sau đây là các định đề về lý thuyết của ông:
- Mọi vật chất đều được tạo thành từ các nguyên tử.
- Nguyên tử không phân chia được.
- Các nguyên tố cụ thể chỉ có một loại nguyên tử trong chúng.
- Mỗi nguyên tử có khối lượng không đổi của riêng nó thay đổi theo từng nguyên tố.
- Các nguyên tử trải qua sự sắp xếp lại trong một phản ứng hóa học.
- Nguyên tử không thể được tạo ra cũng như không bị tiêu diệt mà có thể chuyển từ dạng này sang dạng khác.
Lý thuyết nguyên tử của Dalton đã giải thích thành công các Quy luật của phản ứng hóa học , đó là Định luật bảo toàn khối lượng, Định luật hằng số, Định luật bội số và Định luật tương hỗ.
Những điểm mạnh của Lý thuyết nguyên tử của Dalton
- Lý thuyết không thể giải thích sự tồn tại của đồng vị.
- Không có gì về cấu trúc của nguyên tử được giải thích một cách thích hợp.
- Sau đó, các nhà khoa học phát hiện ra các hạt bên trong nguyên tử chứng tỏ, các nguyên tử có thể phân chia được.
Việc phát hiện ra các hạt bên trong nguyên tử đã dẫn đến sự hiểu biết tốt hơn về các loài hóa học, những hạt bên trong nguyên tử này được gọi là hạt hạ nguyên tử. Việc phát hiện ra các hạt hạ nguyên tử khác nhau như sau:
Mô hình nguyên tử Thomson
Nhà hóa học người Anh, Sir Joseph John Thomson đã đưa ra mô hình của mình mô tả cấu trúc nguyên tử vào đầu những năm 1900.
Sau đó, ông đã được trao giải Nobel cho việc khám phá ra “điện tử” . Công việc của ông dựa trên một thí nghiệm gọi là thí nghiệm tia âm cực . Cấu tạo làm việc của thí nghiệm như sau:
Thí nghiệm tia âm cực
Nó có một ống làm bằng thủy tinh có hai lỗ, một cho bơm chân không và một cho đầu vào để bơm khí vào.


Vai trò của bơm chân không là duy trì “chân không một phần” bên trong buồng kính. Nguồn điện cao áp được nối bằng cách sử dụng các điện cực tức là cực âm và cực dương được lắp bên trong ống thủy tinh.
Quan sát:
- Khi bật nguồn điện cao áp thì có tia ló ra từ catốt về phía anốt. Điều này đã được xác nhận bởi ‘Điểm huỳnh quang’ trên màn hình ZnS được sử dụng. Những tia này được gọi là “Tia Cathode”.
- Khi có điện trường ngoài tác dụng, các tia âm cực bị lệch về phía điện cực dương, nhưng trong trường hợp không có điện trường, các tia âm cực sẽ chuyển động theo đường thẳng.
- Khi các Lưỡi rôto được đặt trên đường đi của các tia âm cực, chúng dường như quay. Điều này chứng tỏ tia âm cực được tạo thành từ các hạt có khối lượng nhất định nên chúng có năng lượng nhất định.


- Với tất cả bằng chứng này, Thompson kết luận rằng tia âm cực được tạo ra từ các hạt mang điện tích âm gọi là “electron”.
- Khi áp dụng điện trường và từ trường lên các tia âm cực (electron), Thomson đã tìm ra tỷ lệ điện tích trên khối lượng (e / m) của electron. (e / m) cho electron: 17588 × 10 11 e / bg.
Từ tỷ lệ này, Mullikin đã tìm ra điện tích của electron thông qua thí nghiệm giọt dầu . [Điện tích của e – = 1,6 × 10 -16 C và khối lượng của e – = 9.1093 × 10 -31 kg].
Kết luận:
Dựa trên các kết luận từ thí nghiệm tia âm cực của mình, Thomson đã mô tả cấu trúc nguyên tử như một quả cầu tích điện dương, trong đó có các electron mang điện tích âm nhúng vào.
Nó thường được gọi là “mô hình bánh pudding mận” vì nó có thể được hình dung như một món bánh pudding mận trong đó bánh pudding mô tả nguyên tử tích điện dương và các miếng mận mô tả các electron.
Cấu trúc nguyên tử của Thomson mô tả các nguyên tử là trung hòa về điện, tức là các điện tích dương và âm có độ lớn bằng nhau.
Hạn chế của cấu trúc nguyên tử của Thomson : Mô hình nguyên tử của Thomson không giải thích rõ ràng về tính ổn định của nguyên tử. Ngoài ra, những khám phá sâu hơn về các hạt hạ nguyên tử khác, không thể được đặt bên trong mô hình nguyên tử của ông.
Lý thuyết nguyên tử Rutherford
Rutherford, một sinh viên của JJ Thomson đã sửa đổi cấu trúc nguyên tử với việc phát hiện ra một hạt hạ nguyên tử khác được gọi là “Hạt nhân” . Mô hình nguyên tử của ông dựa trên thí nghiệm tán xạ tia Alpha.
Thử nghiệm tán xạ tia alpha
Xây dựng:
- Người ta lấy một lá vàng rất mỏng có độ dày 1000 nguyên tử.
- Tia alpha (Helium He 2+ tích điện gấp đôi ) được tạo ra để bắn phá lá vàng.
- Màn chắn Zn S được đặt sau lá vàng.
Quan sát:
- Hầu hết các tia vừa đi qua lá vàng tạo ra các đốm sáng (điểm sáng) trong màn ZnS .
- Một vài tia bị phản xạ sau khi đập vào lá vàng.
- Cứ 1000 tia thì có một tia bị phản xạ lại một góc 180 ° (đường thu lại) sau khi va vào lá vàng.
Kết luận:
- Vì hầu hết các tia đi qua, Rutherford kết luận rằng phần lớn không gian bên trong nguyên tử là trống.
- Một số tia bị phản xạ do lực đẩy của dương của nó với một số điện tích dương khác bên trong nguyên tử.
- 1/1000 tia bị lệch hướng mạnh vì một điện tích dương rất mạnh ở tâm nguyên tử. Ông gọi điện tích dương mạnh này là “hạt nhân”.
- Ông cho biết phần lớn điện tích và khối lượng của nguyên tử nằm trong Hạt nhân
Cấu trúc nguyên tử của Rutherford
Dựa trên những quan sát và kết luận trên, Rutherford đã đề xuất cấu trúc nguyên tử của riêng mình như sau.
- Hạt nhân nằm ở trung tâm của nguyên tử, nơi tập trung phần lớn điện tích và khối lượng.
- Cấu trúc nguyên tử là hình cầu.
- Các electron quay quanh hạt nhân theo quỹ đạo tròn, tương tự như cách các hành tinh quay quanh mặt trời.
Hạn chế của Mô hình nguyên tử Rutherford
- Nếu các điện tử phải quay xung quanh hạt nhân, chúng sẽ tiêu tốn năng lượng và chống lại lực hút mạnh từ hạt nhân, các điện tử sẽ tiêu tốn rất nhiều năng lượng và cuối cùng, chúng sẽ mất hết năng lượng và sẽ rơi vào hạt nhân nên không giải thích được tính ổn định của nguyên tử.
- Nếu các electron liên tục quay xung quanh hạt nhân ‘thì loại quang phổ được mong đợi là quang phổ liên tục. Nhưng trong thực tế, những gì chúng ta thấy là một quang phổ vạch.
Các hạt hạ nguyên tử
Proton
- Proton là các hạt hạ nguyên tử mang điện tích dương. Điện tích của một proton là 1e, tương ứng với khoảng 1,602 × 10 -19
- Khối lượng của một proton xấp xỉ 1,672 × 10 -24
- Proton nặng hơn electron hơn 1800 lần.
- Tổng số proton trong nguyên tử của một nguyên tố luôn bằng số hiệu nguyên tử của nguyên tố đó.
Nơtron
- Khối lượng của một nơtron gần bằng khối lượng của một proton tức là 1,674 × 10 -24
- Nơtron là hạt trung hòa về điện và không mang điện tích.
- Các đồng vị khác nhau của một nguyên tố có cùng số proton nhưng khác nhau về số nơtron có trong hạt nhân tương ứng của chúng.
Điện tử
- Điện tích của một electron là -1e, xấp xỉ -1,602 × 10 -19
- Khối lượng của một electron là khoảng 9,1 × 10 -31 .
- Do khối lượng tương đối không đáng kể của các electron, chúng được bỏ qua khi tính khối lượng của nguyên tử.
Cấu trúc nguyên tử của đồng vị
Hạt nhân là thành phần cấu tạo nên hạt nhân của nguyên tử. Một nucleon có thể là một proton hoặc một neutron. Mỗi nguyên tố có một số proton duy nhất trong đó, được mô tả bằng số nguyên tử duy nhất của nó . Tuy nhiên, một số cấu trúc nguyên tử của một nguyên tố có thể tồn tại, những cấu trúc này khác nhau về tổng số nucleon.
Các biến thể này của các nguyên tố có số nucleon khác nhau (còn được gọi là số khối) được gọi là đồng vị của nguyên tố. Do đó, các đồng vị của một nguyên tố có cùng số proton nhưng khác nhau về số nơtron.
Cấu trúc nguyên tử của một đồng vị được mô tả với sự trợ giúp của ký hiệu hóa học của nguyên tố, số hiệu nguyên tử của nguyên tố và số khối của đồng vị. Ví dụ, tồn tại ba đồng vị tự nhiên đã biết của hydro , đó là proti, đơteri và triti. Cấu trúc nguyên tử của các đồng vị hydro này được minh họa dưới đây.


Các đồng vị của một nguyên tố khác nhau về độ ổn định. Chu kỳ bán rã của các đồng vị cũng khác nhau. Tuy nhiên, chúng thường có hành vi hóa học tương tự do thực tế là chúng có cấu trúc điện tử giống nhau .
Cấu trúc nguyên tử của một số nguyên tố
Cấu trúc nguyên tử của một nguyên tố có thể được biểu diễn đơn giản qua tổng số proton, electron và neutron có trong nó. Cấu trúc nguyên tử của một số nguyên tố được minh họa dưới đây.
Hydrogen
Đồng vị hydro phong phú nhất trên hành tinh Trái đất là protium. Số hiệu nguyên tử và số khối của đồng vị này lần lượt là 1 và 1.
Cấu trúc của nguyên tử Hydro: Điều này ngụ ý rằng nó chứa một proton, một electron và không có neutron (tổng số neutron = số khối – số hiệu nguyên tử)
Carbon
Carbon có hai đồng vị bền – 12C và 13C. Trong số các đồng vị này, 12C có độ phong phú là 98,9%. Nó chứa 6 proton, 6 electron và 6 neutron.
Cấu tạo của nguyên tử Cacbon: Các electron được phân bố thành hai lớp vỏ và lớp vỏ ngoài cùng (lớp vỏ hóa trị) có 4 electron. Tính tứ hóa của cacbon cho phép nó hình thành nhiều loại liên kết hóa học với các nguyên tố khác nhau.
Ôxy
Tồn tại ba đồng vị bền của oxi – 18O, 17O và 16O. Tuy nhiên, oxy-16 là đồng vị dồi dào nhất.
Cấu tạo của nguyên tử Oxy: Vì số hiệu nguyên tử của đồng vị này là 8 và số khối là 16, nên nó bao gồm 8 proton và 8 neutron. 6 trong số 8 electron trong nguyên tử oxi nằm ở lớp vỏ hóa trị.
Lý thuyết nguyên tử của Bohr
Neils Bohr đưa ra mô hình nguyên tử của mình vào năm 1915. Đây là mô hình nguyên tử được sử dụng rộng rãi nhất để mô tả cấu trúc nguyên tử của một nguyên tố dựa trên lý thuyết lượng tử hóa của Planck .
Định đề:
- Các electron bên trong nguyên tử được đặt trong các quỹ đạo rời rạc được gọi là “quỹ đạo văn phòng phẩm”.
- Mức năng lượng của các lớp vỏ này có thể được biểu diễn thông qua các số lượng tử.
- Các electron có thể nhảy lên các mức cao hơn bằng cách hấp thụ năng lượng và di chuyển đến các mức năng lượng thấp hơn bằng cách làm mất hoặc phát ra năng lượng của nó.
- Miễn là, một electron vẫn ở trong văn phòng phẩm của chính nó, sẽ không có sự hấp thụ hoặc phát xạ năng lượng.
- Các electron chỉ xoay quanh hạt nhân trong các quỹ đạo văn phòng phẩm này.
- Năng lượng của các quỹ đạo đứng yên được lượng tử hóa.
Hạn chế của lý thuyết nguyên tử của Bohr:
- Cấu trúc nguyên tử của Bohr chỉ hoạt động đối với các loại electron độc thân như H, He +, Li2 +, Be3 +,….
- Khi quang phổ phát xạ của hydro được quan sát dưới một máy quang phổ chính xác hơn, mỗi quang phổ vạch được coi là sự kết hợp của không có các vạch rời rạc nhỏ hơn.
- Cả hai hiệu ứng Stark và Zeeman đều không thể giải thích bằng lý thuyết của Bohr.
Nguyên lý bất định của Heisenberg : Heisenberg tuyên bố rằng không có hai đại lượng vật lý liên hợp nào có thể được đo đồng thời với độ chính xác 100%. Đây sẽ luôn là một số lỗi hoặc độ không đảm bảo trong phép đo.
Nhược điểm: Vị trí và động lượng là hai đại lượng liên hợp được Bohr đo chính xác (theo lý thuyết).
Hiệu ứng Stark: Hiện tượng lệch hướng của các êlectron khi có điện trường.
Hiệu ứng Zeeman: Hiện tượng lệch hướng của các electron khi có từ trường.
Bản chất kép của vật chất
Các electron được coi là các hạt, bằng chứng về hiệu ứng quang điện cho thấy chúng cũng có bản chất sóng. Điều này đã được chứng minh bởi Thomas young với sự trợ giúp của thí nghiệm khe đôi của mình .
De-Broglie kết luận rằng vì bản chất là đối xứng nên ánh sáng hay bất kỳ sóng vật chất nào khác cũng vậy.
Số lượng tử
- Số lượng tử chính (n): Biểu thị số quỹ đạo hoặc số lớp vỏ của electron.
- Số lượng tử phương vị ( l ): Nó biểu thị quỹ đạo (quỹ đạo con) của electron.
- Số lượng tử từ: Nó biểu thị số trạng thái năng lượng trong mỗi quỹ đạo.
- Spin Số lượng tử: Nó biểu thị hướng quay, S = -½ = Ngược chiều kim đồng hồ và ½ = Chiều kim đồng hồ.
Cấu hình điện tử của một nguyên tử
Các electron phải được điền vào các s, p, d, f theo quy tắc sau.
1. Nguyên lý Aufbau: Sự lấp đầy các electron phải diễn ra theo thứ tự năng lượng tăng dần của các obitan:
- Các quỹ đạo năng lượng thấp hơn nên được lấp đầy trước tiên và các mức năng lượng cao hơn.
- Năng lượng của obitan α (p + l) giá trị mà hai obitan có cùng giá trị (n + l ), E α n
- Thứ tự tăng dần của năng lượng 1s, 2s, 2p, 3s, 3p, 4s, 3d ,. . .
2. Nguyên tắc loại trừ của Pauli: Không có hai điện tử nào có thể có tất cả bốn số lượng tử giống nhau hoặc, nếu hai điện tử phải đặt ở trạng thái năng lượng thì chúng phải được đặt với các gián điệp ngược chiều nhau.
3. Quy tắc đa bội cực đại của Hund: Trong trường hợp lấp đầy các obitan suy biến (cùng năng lượng), tất cả các obitan suy biến phải được lấp đầy đơn lẻ trước và sau đó chỉ xảy ra sự kết đôi.
Các câu hỏi thường gặp về cấu trúc nguyên tử
Hạt hạ nguyên tử là gì?
Hạt hạ nguyên tử là những hạt cấu thành nguyên tử. Nói chung, thuật ngữ này dùng để chỉ các proton, electron và neutron.
Cấu trúc nguyên tử của các đồng vị khác nhau như thế nào?
Chúng khác nhau về tổng số neutron có trong hạt nhân của nguyên tử, được mô tả bằng số nucleon của chúng.
Những thiếu sót của mô hình nguyên tử Bohr là gì?
Theo mô hình nguyên tử này, cấu trúc của nguyên tử đưa ra những dự đoán phổ kém hơn đối với các nguyên tử lớn hơn. Nó cũng không giải thích được hiệu ứng Zeeman. Nó chỉ có thể giải thích thành công quang phổ hydro.
Có thể xác định tổng số nơtron trong hạt nhân của một đồng vị nhất định bằng cách nào?
Số khối của một đồng vị được cho bằng tổng của tổng số proton và neutron trong nó. Số hiệu nguyên tử mô tả tổng số proton trong hạt nhân. Do đó, số lượng nơtron có thể được xác định bằng cách lấy số khối trừ đi số nguyên tử.
Xem thêm: