Tính chất và công dụng của Titanium Dioxide (TiO2) chi tiết nhất
13 Tháng Bảy, 2021Contents Titanium dioxide là gì (TiO2)? Titanium dioxide là một hợp chất hóa học có công thức hóa học...
Contents
C2H5NO là một hợp chất vô cơ có tên hóa học Acetamide.
Acetamide còn được gọi là acetic acid amide, hoặc Ethanamide hoặc axit Acetimidic. Nó có nguồn gốc từ axit axetic và là amide đơn giản nhất. Nó được sử dụng rộng rãi như một chất làm dẻo.
Ethanamide thu được dưới dạng chất rắn hút ẩm không màu và có mùi mousy. Nó dễ hòa tan trong nước, chloroform, benzen nóng, glycerol và hơi hòa tan trong ether. Nó là một thành viên của lớp acetamides là kết quả của sự ngưng tụ chính thức của axit axetic (CH3COOH) với amoniac (NH3). Nó được tìm thấy tự nhiên trong củ cải đỏ.
| C2H5NO | Axetatamide |
| Trọng lượng phân tử/khối lượng mol của C2H5Không | 59,068 g/mol |
| Mật độ acetamide | 1,159 g / cm3 |
| Điểm sôi của Acetamide | 221,2 °C |
| Điểm nóng chảy của Acetamide | 79 đến 81 °C |
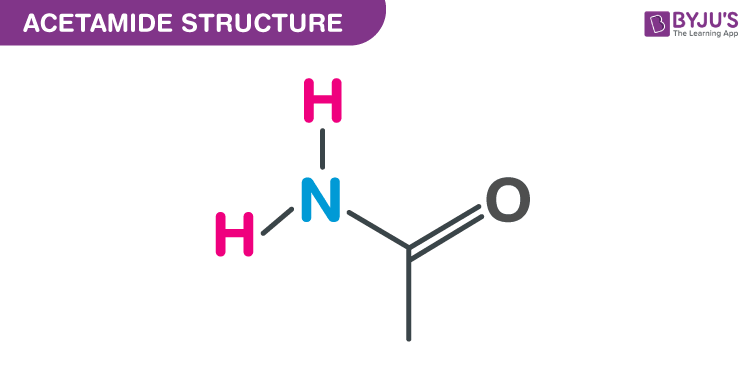

Cấu trúc Acetamide – C2H5NO
Trong các phòng thí nghiệm hóa học, nó có thể được sản xuất bằng cách mất nước amoni axetat. Phản ứng như sau:
[NH4[CH3Đồng2] → CH3C(O)NH2 + H2O
Nó cũng có thể thu được thông qua ammonolysis acetylacetone với các điều kiện được sử dụng trong amination giảm.
Thay vào đó, nó có thể được sản xuất từ axit axetic khan (CH3COOH), khí hydro clorua khô và acetonitrile trong bồn tắm nước đá cùng với thuốc thử acetyl clorua.
Ở quy mô công nghiệp, nó có thể được sản xuất bằng cách khử nước amoni axetat hoặc bằng cách thủy phân acetonitrile.
Ch3CN + H2O → CH3C(O)NH2
Nó dễ cháy và tạo ra khí độc hoặc khói khi đun nóng. Tiếp xúc với axit axetic amide có thể gây kích ứng cho màng nhầy, da và mắt. Nó cũng có thể gây tổn thương giác mạc.
Acetamide là một hợp chất hữu cơ có công thức CH3CONH2. Đây là amide đơn giản nhất của các dẫn xuất axit axetic. Acetamide được sử dụng trong sản xuất các sản phẩm polymer, chẳng hạn như polyvinyl acetamide, một mặt hàng polymer được sử dụng làm chất hấp thụ, như một đồng monome.
Amide chính được hình thành từ NH2, nhóm amin thay thế nhóm hydroxyl cacboxylic. Một trường hợp điển hình là acetamide (axit axetic + amide). Trọng lượng phân tử thấp gây ra bởi sự hình thành liên kết hydro hòa tan trong nước.
Acetamide là một hóa chất có nguồn gốc từ axit axetic đã được xác định là có mùi như giấm hoặc amoniac. Nó sẽ bám vào những nơi mà cơ bắp đang ngủ và sẽ có được thức ăn scrounge.
Những phát hiện chính là amoniac và acetamide là nước và HCl hòa tan vì chúng là các phân tử nhỏ hơn. Các hợp chất triethylamine, aniline và N, N-dimethylaniline không được biết là hòa tan trong nước và HCl, nhưng hòa tan trong MTBE. MTBE không hòa tan trong amoniac và acetamide.
Sự hiện diện của một cặp electron đơn độc trên đế xác định cường độ của nó vì các electron này là những electron sẽ “lau” các ion H + trong dung dịch và do đó làm tăng độ pH đối với các điều kiện kiềm hơn. Phenylamine cũng là một cơ sở yếu hơn ethylamine vì có ít hơn một cặp đơn độc.
Xem thêm: