Tính chất và công dụng của Magiê Cacbonat (MgCO3) chi tiết nhất
13 Tháng Bảy, 2021Contents Magiê Cacbonat là gì? MgCO3 là một loại muối vô cơ có tên hóa học Là Magiê Cacbonat. Nó...
Contents
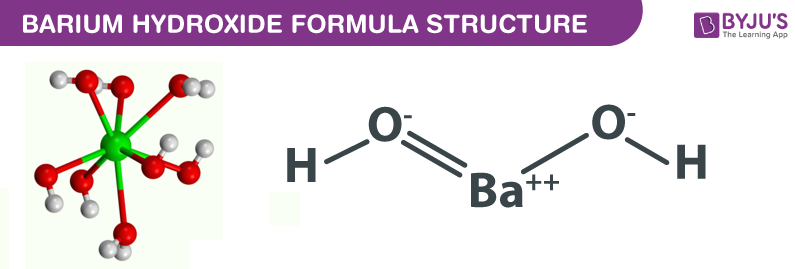
Bari hydroxit còn được gọi là baryta với công thức Ba(OH)2. Nó là một loại bột màu trắng trong không có mùi. Nó có độc trong tự nhiên. Nó là ion trong tự nhiên ví dụ, Ba (OH)2 (bari hydroxit) trong dung dịch nước có thể cung cấp hai ion hydroxit cho mỗi phân tử. Bari hydroxit là thuốc thử duy nhất được mô tả để kim loại hóa carboxamidesBarium hydroxit ít phân hủy hơn so với oxit bari.
Tên khác – Baryta ăn da, Bari dihydroxide, bari (2+) dihydroxide
| Ba(OH)2 | Bari Hydroxit |
| mật độ | 3,74 g / cm³ |
| Trọng lượng phân tử / Khối lượng mol | 171,34 g/mol |
| Điểm sôi | 780 °C |
| Điểm nóng chảy | 78 °C |
| Công thức hóa học | Bah2O2 |

| mùi | Không mùi |
| bề ngoài | Chất rắn màu trắng |
| Đơn vị liên kết cộng hóa trị | 3 |
| Áp suất hơi | 0,48 kPa ở 17,6 độ C |
| Ph | 11.27 |
| Độ hòa tan | Hơi hòa tan trong nước lạnh |
Trong công nghiệp, bari hydroxit được sử dụng làm tiền thân của một số hợp chất bari khác. Monohydrat của hợp chất này được sử dụng rộng rãi để khử nước và chiết xuất sunfat từ các sản phẩm khác nhau. Độ hòa tan rất thấp của bari sunfat được sử dụng trong ứng dụng này.
Bari hydroxit thường được điều chế bằng cách hòa tan bari oxit (công thức hóa học: BaO) trong nước. Phương trình hóa học cho phản ứng này được cung cấp dưới đây.
BaO + 9 H2O → Ba(OH)2·8H2O
Có thể lưu ý rằng hợp chất này kết tinh thành dạng octahydrat, sau đó được chuyển đổi thành monohydrat bằng cách làm nóng nó trong không khí.
Khi đun nóng đến 800 ° C, bari hydroxit phân hủy để tạo ra oxit bari. Bari cacbonat được cung cấp bởi phản ứng với carbon dioxide. Dung dịch nước kiềm mạnh trải qua các phản ứng trung hòa với axit.
Xem thêm: