Sarcoma biểu mô của âm hộ là gì? Các triệu chứng, nguyên nhân, điều trị
20 Tháng Một, 2021Contents Tổng quan về sacôm biểu mô của âm hộ Sarcoma biểu mô của âm hộ là một khối u...
Contents
Bệnh bạch cầu mãn tính dòng tủy (CML) là một bệnh tăng sinh vô tính của tế bào gốc tạo máu. Tủy xương chủ yếu có đặc điểm là tăng sản dòng tủy, tăng bạch cầu trong máu ngoại vi và lách to.

Bức xạ ion hóa có thể làm tăng tỷ lệ mắc CML. Tỷ lệ mắc CML ở những người sống sót ở Hiroshima và các vụ đánh bom nguyên tử trong thời gian dài, bệnh nhân viêm cột sống dính khớp được xạ trị cột sống và bệnh nhân ung thư cổ tử cung được xạ trị cao hơn đáng kể so với các quần thể khác. Tiếp xúc lâu dài với benzen và các bệnh nhân khối u khác nhau đang hóa trị có thể gây ra CML, cho thấy rằng một số hóa chất cũng liên quan đến CML. Sự gia tăng tần số kháng nguyên HLA CW3 và CW4 ở bệnh nhân CML cho thấy họ có thể là gen nhạy cảm với CML. Mặc dù các báo cáo về CML gia đình, các cụm CML gia đình rất hiếm. Ngoài ra, tỷ lệ mắc CML ở các thành viên khác của cặp song sinh đơn hợp tử không tăng. Cha mẹ và con cái của bệnh nhân CML không có nhiễm sắc thể Ph đặc trưng của CML, cho thấy CML là bệnh mắc phải Bệnh bạch cầu không liên quan gì đến yếu tố di truyền.
1. Bắt nguồn từ tế bào gốc tạo máu CML là một bệnh vô tính mắc phải có nguồn gốc từ tế bào gốc tạo máu, các bằng chứng chính là: ① Trong giai đoạn mãn tính của CML, có thể có hồng cầu, bạch cầu trung tính, bạch cầu ái toan / ưa bazơ, bạch cầu đơn nhân và Tăng tiểu cầu ; ② Tế bào tuyến giáp, bạch cầu trung tính, bạch cầu ái toan / bạch cầu ưa bazơ, đại thực bào và tế bào megakaryocytes ở bệnh nhân CML đều có nhiễm sắc thể Ph; ③Trong bệnh nhân CML nữ dị hợp tử G-6-PD, tế bào hồng cầu, Bạch cầu trung tính, bạch cầu ái toan / ưa bazơ, bạch cầu đơn nhân và tiểu cầu biểu hiện cùng một isoenzyme G-6-PD, trong khi nguyên bào sợi hoặc các tế bào soma khác có thể phát hiện hai isoenzyme G-6-PD. Work-enzyme; ④ Sự bất thường về cấu trúc của nhiễm sắc thể 9 hoặc 22 trong mỗi tế bào được phân tích là giống nhau; ⑤ Nghiên cứu sinh học phân tử Sự biến đổi của điểm đứt của nhiễm sắc thể 22 chỉ tồn tại ở những bệnh nhân CML khác nhau và điểm đứt của nó nằm ở các tế bào khác nhau của cùng một bệnh nhân Nó nhất quán; ⑥ Ứng dụng của phân tích đa hình locus gen liên kết X và phân tích mẫu bất hoạt cũng xác nhận rằng CML là cơ chế tạo máu đơn dòng.
2. Chức năng bất thường của tế bào tiền thân Tế bào tiền thân tương đối trưởng thành có tính năng động tế bào bất thường rõ ràng, chỉ số phân cắt thấp, ít tế bào trong giai đoạn tổng hợp DNA, chu kỳ tế bào kéo dài, phát triển không cân bằng nucleoplasmic và chu kỳ bán hủy của bạch cầu hạt trưởng thành hơn bình thường Bạch cầu hạt dài ra. Thử nghiệm tự sát 3H khẳng định rằng chỉ có 20% khuẩn lạc CML đang trong giai đoạn tổng hợp DNA, so với 40% ở người bình thường. Chỉ số đánh dấu của tế bào CML và tế bào tiền bào thấp hơn so với đối tượng bình thường, trong khi chỉ số đánh dấu của nguyên bào tủy giữa và cuối trái ngược với đối tượng bình thường. Không có sự khác biệt đáng kể so với các bức ảnh. Cấy khuẩn lạc tế bào tiền thân tạo máu nhận thấy khả năng tăng sinh của tế bào tiền thân tủy xương CML khác với tế bào tiền thân máu ngoại vi. So với đối chứng bình thường, số lượng CFU-GM và BFU-E tủy xương thường tăng, nhưng có thể bình thường hoặc giảm, trong khi máu ngoại vi có thể tăng Để 100 lần so với điều khiển bình thường. Nghiên cứu nuôi cấy dài hạn tế bào tủy xương của bệnh nhân CML dương tính cho thấy tế bào tiền thân Ph âm tính có thể được phát hiện trong môi trường nuôi cấy sau vài tuần nuôi cấy. Điều này đã được khẳng định rằng nguyên nhân chủ yếu là do sự kết dính bất thường của tế bào tiền thân tạo máu CML.
3. Bệnh học phân tử Năm 1960, Nowell và Hungerfor mô tả nhiễm sắc thể Ph liên quan đến CML, đây là bất thường nhiễm sắc thể không ngẫu nhiên đầu tiên liên quan đến một khối u cụ thể ở người . Năm 1973, Rowley sử dụng kỹ thuật nhuộm quinine và Giemsa để lần đầu tiên xác nhận rằng nhiễm sắc thể Ph (22q-bất thường) được tìm thấy trong CML là do chuyển đoạn nhiễm sắc thể t (9; 22) (q34; q11). Năm 1982, gen ABL được nhân bản trong vùng đứt gãy 9q34. Năm 1983, người ta xác nhận rằng đoạn gen nằm ở q34 đã chuyển vị trên nhiễm sắc thể số 22 để tạo thành gen dung hợp BCR-ABL với gen gọi là BCR trong đoạn đứt đoạn 22q11.
(1) Gen ABL: Gen proto-oncogene c-abl nằm ở q34 và được bảo tồn cao trong quá trình phát triển của loài. Nó mã hóa một loại protein được biểu hiện phổ biến trong tất cả các mô của động vật có vú và nhiều loại tế bào khác nhau. Chiều dài của c-abl là khoảng 230kb, Chứa 11 exon, hướng từ điểm cuối 5 ‘đến tâm động. Exon đầu tiên của gen này có hai dạng, exon 1a và 1b, do đó có hai mRNA c-abl khác nhau. Exon đầu tiên được gọi là 1a-11, dài 6kb và bao gồm các exon 1a-11 ; Cái còn lại được gọi là 1b, bắt đầu từ exon 1b, kéo dài exon 1a và intron đầu tiên, kết nối với exon 2-11 và có chiều dài 6kb. Hai mã phiên mã ABL RNA này Hai protein ABL khác nhau có trọng lượng phân tử là 145.000. Phân tích trình tự DNA được tìm thấy. c-abl thuộc họ protein-tyrosine kinase không thụ thể, ngoài các đoạn kinase, gen này còn có các đoạn SH2 và SH3 rất quan trọng trong sự tương tác và điều hòa các protein dẫn truyền tín hiệu. Đặc điểm của c-abl là Đoạn không xúc tác lớn ở đầu C chứa trình tự quan trọng của liên kết DNA và bộ xương tế bào và một vùng tham gia vào quá trình truyền tín hiệu. P145ABL bình thường di chuyển giữa nhân và tế bào chất, chủ yếu nằm trong nhân, và có hoạt tính tyrosine kinase thấp. Hoạt động và khu trú nội bào của p145ABL được điều chỉnh bởi các tích phân kết nối giữa tế bào và chất nền ngoại bào. Các nghiên cứu hiện tại đã chỉ ra rằng ít nhất trong nguyên bào sợi, việc kích hoạt ABL đòi hỏi sự kết dính của tế bào. Do đó, ABL có thể truyền tín hiệu tích phân đến nhân. Nó hoạt động như một cầu nối giữa sự kết dính và các tín hiệu chu kỳ tế bào, đồng thời tham gia vào quá trình kiểm soát sự phát triển và biệt hóa của tế bào.
(2) Gen BCR: Gen BCR nằm ở 22q11, dài 130kb, có 21 exon và bắt đầu từ đầu 5 đến trung tâm. Có hai phương pháp phiên mã BCR mRNA khác nhau là 4,5kb và 6,7kb, mã hóa protein p160 BCR với trọng lượng phân tử 160.000, có hoạt tính kinase. Đầu cuối C của p160 BCR liên quan đến hoạt động GTP của protein liên kết GTP liên quan đến ras p21.
(3) Gen BCR-ABL: Gen c-abl ở vị trí 9q34 dễ dàng nằm trên nhiễm sắc thể số 22 và gen bcr ở vị trí 22q11 tạo thành gen dung hợp BCR-ABL. Cho đến nay, 3 cụm điểm ngắt bcr đã được tìm thấy ở bệnh nhân CML, đó là M-bcr, m-bcr, u-bcl và phương pháp phiên mã 6 BCR-ABL. M-bcr tương ứng là b2a2, b3a2, b2a3 , Protein mã hóa của nó là p210, tương ứng với m-bcr là ela2, protein mã hóa của nó là p190 và tương ứng với u-bcr là e19a2, và protein mã hóa của nó là p230.
Trong các mô hình chuột, người ta đã xác nhận rằng BCR-ABL có thể gây ra CML. Protein dung hợp BCR-ABL nằm trong tế bào chất và có hoạt tính tyrosine kinase cực cao. Bằng cách thay đổi một số phốt phát protein điều hòa chính là chất nền xúc tác của BCR-ABL Các điều kiện hóa học kích hoạt nhiều con đường dẫn truyền tín hiệu khác nhau. Ví dụ, bằng cách kích hoạt con đường tín hiệu Ras liên quan đến quy định tăng sinh và biệt hóa tế bào, số lượng tế bào tiền thân tăng lên, nhóm tế bào gốc giảm và tế bào gốc trở thành một phần của nhóm tăng sinh, do đó các tế bào hạt chưa trưởng thành tiếp tục mở rộng. Một cơ chế hoạt động khác của BCR-ABL là thay đổi chức năng của các tích phân bình thường. Các tế bào tiền thân tạo máu bình thường bám vào chất nền ngoại bào. Sự kết dính được trung gian bởi các thụ thể bề mặt tế bào của tế bào tiền thân, đặc biệt là các tích phân. BCR-ABL can thiệp vào β1 Chức năng của tích phân dẫn đến khiếm khuyết trong chức năng kết dính tế bào của tế bào CML, do đó các tế bào chưa trưởng thành được giải phóng vào máu ngoại vi và di chuyển đến vị trí ngoại tủy.
Gần đây, nghiên cứu về cơ chế bệnh sinh của CML đã đạt được những tiến bộ hơn nữa: culture Nuôi cấy trong ống nghiệm thấy rằng BCR-ABL kéo dài thời gian tăng trưởng không phụ thuộc vào yếu tố của các tế bào tiền thân CML bằng cách ức chế quá trình apoptosis; ②Sau khi điều chỉnh giảm sự biểu hiện của BCR-ABL bằng các oligonucleotide antisense Có thể ức chế sự phát triển của tế bào bệnh bạch cầu ở chuột bằng cách tăng độ nhạy cảm của tế bào với quá trình chết rụng, đặc biệt là giảm sự hình thành khuẩn lạc của tế bào tiền thân ban đầu của bệnh nhân CML và giảm sự tăng sinh tế bào của các dòng tế bào giống CML; ③ Biểu hiện BCR-ABL, được biến đổi, Tế bào tạo máu của chuột không phụ thuộc vào yếu tố và có khối u tăng nhạy cảm với quá trình chết rụng bằng cách điều hòa lên bcl-2. Khi sự biểu hiện của bcl-2 bị ức chế, các tế bào dương tính BCR-ABL trở nên phụ thuộc vào yếu tố và Không gây khối u. Các kết quả thực nghiệm trên cho thấy BCR-ABL ức chế quá trình apoptosis và dẫn đến sự mở rộng liên tục của các tế bào dòng tủy là một cơ chế bệnh sinh khác của CML.
(4) Cơ chế thay đổi nhanh chóng: Các nghiên cứu di truyền tế bào đã phát hiện ra rằng 80% bệnh nhân AP hoặc BP CML có bất thường nhiễm sắc thể thứ cấp, các bất thường phổ biến nhất là +8, + Ph, i (17), +19, +21 và -Y. Khoảng 80% bệnh nhân bị bệnh bạch cầu dòng tủy cấp tính (bệnh u hạt cấp tính) có bất thường nhiễm sắc thể không ngẫu nhiên, karyotype nhiễm sắc thể của họ thường là dị bội, bất thường phổ biến nhất là +8, và +8 thường liên quan đến các nhiễm sắc thể khác Các bất thường như i (17), + Ph, +19, v.v. xuất hiện đồng thời, tiếp theo là + Ph, i (17) và -Y. Biến thể bệnh bạch cầu nguyên bào lympho cấp tính (biến thể bệnh nhân nguyên bào lympho cấp tính ) của khoảng 30% bất thường nhiễm sắc thể dòng vô tính thứ cấp, thường là mất nhiễm sắc thể, do đó hiệu suất của các bất thường cấu trúc hoặc lưỡng bội, và các bất thường phổ biến + Ph-Y, + 8 là hiếm, i (17) chưa được báo cáo, và -7, 14q + có liên quan cụ thể đến bệnh nguyên bào lympho cấp tính. Mặc dù một số nghiên cứu đã phát hiện ra rằng đột biến gen N-Ras và biểu hiện gen c-Myc làm tăng CML trong giai đoạn đạo ôn, nhưng tỷ lệ mắc bệnh của nó là cực kỳ thấp. Gen Rb hiếm khi bị thay đổi ở bệnh nhân CML trong giai đoạn blast. Sill và cộng sự nhận thấy rằng sự xóa bỏ đồng hợp tử của gen p161NK4A có liên quan đến sự biến đổi nguyên bào lympho cấp tính CML. Cơ chế phân tử của biến đổi cấp tính CML chủ yếu là gen p53. 20% đến 30% bệnh nhân biến đổi dạng hạt cấp tính có cấu trúc và biểu hiện bất thường của gen p53. Đặc điểm của biến đổi gen CMLp53 là: ① Thay đổi chính là sắp xếp lại gen và đột biến; ② Nó chủ yếu được thấy trong thay đổi hạt cấp tính và thay đổi nguyên bào lympho cấp tính là rất hiếm; đột biến ③p53 thường gặp ở những bệnh nhân có bất thường 17P; đột biến ④p53 có thể gây ra thay đổi hạt cấp tính trong CML. Gần đây, đã có những báo cáo nghiên cứu về mối quan hệ giữa mức độ methyl hóa gen calmodulin, chiều dài telomere và những thay đổi hoạt động của telomerase và sự bùng nổ CML, nhưng ý nghĩa của nó vẫn còn được làm sáng tỏ.
Các triệu chứng thường gặp: tăng bạch cầu, đau xương ức, rối loạn thị giác, lách to, thiếu máu, yếu tay chân, sụt cân, gan to, mệt mỏi, sụt cân, sốt nhẹ, sốt
1. Giai đoạn mãn tính
(1) Triệu chứng: Thông thường, hầu hết bệnh nhân CML về mặt lâm sàng đều ở giai đoạn “mãn tính” hoặc “ổn định”, và giai đoạn này có thể kéo dài từ 3 đến 4 năm. Các triệu chứng thường gặp bao gồm: thiếu máu , khó chịu ở lá lách, chảy máu và mệt mỏi , sụt cân và sốt nhẹ . 20% đến 40% bệnh nhân không có triệu chứng, và được chẩn đoán do tăng số lượng bạch cầu, số lượng tiểu cầu hoặc lách to khi khám sức khỏe định kỳ. Một số bệnh nhân bị đau khớp nhỏ do gút . Ngoài ra, còn có rối loạn thị giác, bệnh thần kinh và chứng priapism. Bệnh nhân ở giai đoạn mãn tính không dễ bị nhiễm trùng, và hiếm khi sốt .
(2) Dấu hiệu: Biểu hiện chủ yếu là thâm nhiễm nội tạng. Ở 90% bệnh nhân, lá lách to ra với các mức độ khác nhau, lá lách có thể chạm tới dưới xương sườn và kéo dài đến khoang chậu. Thường có những vết khía rõ ràng với kết cấu cứng. Khi lá lách bị thuyên tắc, có thể cảm thấy ma sát ở vùng lá lách hoặc có thể nghe thấy tiếng kêu. Có thể có phì đại gan từ nhẹ đến trung bình, và hiếm khi mở rộng hạch bạch huyết . Thường có biểu hiện đau ở xương ức, tập trung ở đầu dưới của thân. Thâm nhiễm võng mạc tại nền, có thể thấy sự giãn nở ngoằn ngoèo của các mạch máu võng mạc, cũng như các đốm xuất huyết bong vảy và các trung tâm thâm nhiễm trắng.
2. Thời kỳ đạo ônSau nhiều tháng hoặc nhiều năm ở giai đoạn mãn tính, các tế bào gốc tạo máu ác tính tăng sinh cực độ, nguyên bào tủy xương + tế bào tiền bào ≥ 20%, có thể kèm theo các thay đổi xơ hóa tủy do quá nhiều yếu tố tăng trưởng có nguồn gốc tiểu cầu. Không thể đoán trước khi nào bệnh nhân sẽ thay đổi nhanh chóng. Một khi thay đổi đột ngột, tình trạng bệnh sẽ xấu đi nhanh chóng, điều trị rất khó khăn và thời gian sống sót hiếm khi vượt quá 6 đến 12 tháng.
(1) các triệu chứng: sốt không rõ nguyên nhân, lá lách to hơn nữa; đau xương, chảy máu và thâm nhiễm khối u ngoài tủy khác, chẳng hạn như các hạch bạch huyết, khối da và mô mềm hoặc biến thể STD tiêu xương .
(2) Loại thay đổi đột ngột:
① Khoảng 65% các trường hợp thay đổi bạch cầu hạt cấp tính: bao gồm: A. khủng hoảng blast, thay đổi tình trạng đột ngột, số lượng lớn blast trong tủy xương hoặc máu, blast + promyelocytic> 90%, bệnh phát triển nhanh, diễn biến bệnh. Ngắn, thường tử vong trong vòng 1 đến 2 tháng; B. Biến đổi dạng hạt mãn tính, là quá trình biến đổi của CML sau vài tuần đến vài tháng, tất cả các dấu hiệu của bệnh bạch cầu cấp tính đều xuất hiện. Các hạt nguyên thủy + promyelocytic trong tủy xương> 20%. Nó có khả năng kháng điều trị và thời gian tồn tại không quá 6 tháng.
② khoảng 30% các biến thể nguyên bào lympho cấp tính : một loại phổ biến của bệnh bạch cầu nguyên bào lympho cấp tính (C-ALL), bệnh bạch cầu nguyên bào lympho không T không phải B, bệnh bạch cầu tế bào B và tiền B, bệnh bạch cầu tế bào T. Những thay đổi cấp tính có thể thuyên giảm tạm thời bằng vincristin và prednisone, nhưng cuối cùng chúng sẽ chết trong vòng 0,5 đến 1 năm.
③5% là các dạng biến đổi tủy cấp tính hiếm gặp khác: bao gồm biến đổi mô bào, tổn thương máu đỏ và trắng, biến đổi tế bào megakaryocyte và biến đổi tế bào đơn nhân cấp tính. Hình ảnh máu, hình ảnh tủy xương, hình thái tế bào và các thay đổi khác có các đặc điểm tương ứng và tiên lượng xấu. Hầu hết bệnh nhân tử vong trong vòng 6 tháng sau khi thay đổi đột ngột.
3. Giai đoạn cấp tốcGiữa giai đoạn mãn tính và giai đoạn cấp tính, trong giai đoạn này bắt đầu xuất hiện các hiện tượng lâm sàng như sốt nhẹ và lách to , tình trạng thiếu máu nặng dần, bạch cầu tiếp tục tăng cao, tế bào non bắt đầu tăng sinh hạt ban đầu + bạch cầu hạt ≥ 10%. Sự phản kháng xuất hiện. Nó có thể tiến triển thành một giai đoạn cấp tính điển hình trong vòng vài tuần hoặc vài tháng. Nhiễm sắc thể đã thay đổi trong giai đoạn này, chẳng hạn như giai đoạn cấp tính, do đó sự thay đổi nhiễm sắc thể sớm hơn so với những thay đổi về huyết học và lâm sàng, và có thể được sử dụng như một chỉ số đánh giá tiến triển của bệnh và tiên lượng.
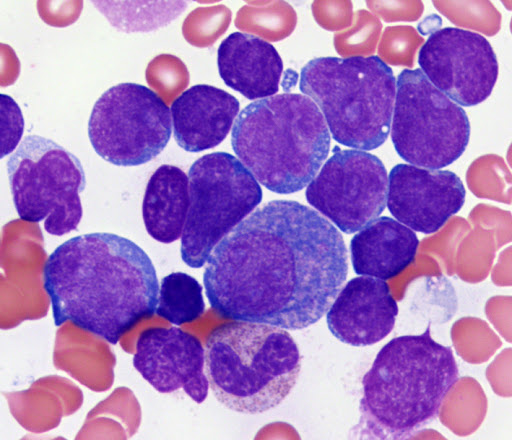
CML điển hình đi kèm với lách to, số lượng bạch cầu máu ngoại vi tăng, bạch cầu hạt chưa trưởng thành, bạch cầu ái toan và bạch cầu ưa bazơ tăng ở các giai đoạn khác nhau. Tăng sản tủy xương rõ ràng hoặc cực kỳ tích cực, chủ yếu là tăng sản bạch cầu hạt, bạch cầu trung tính và bạch cầu hạt nhân hình que, bạch cầu ái toan và (hoặc) basophils cũng tăng, megakaryocytes thường tăng sinh. Điểm phosphatase kiềm của bạch cầu trung tính (ALP) giảm. Xét nghiệm di truyền tế bào có nhiễm sắc thể Ph hoặc phương pháp sinh học phân tử phát hiện sự sắp xếp lại hoặc dung hợp gen BCR-ABL, chẩn đoán không khó.
Tiêu chuẩn chẩn đoán: CML điển hình còn được gọi là bệnh bạch cầu dòng tủy mãn tính (CGL), phải là nhiễm sắc thể Ph dương tính và gen dung hợp BCR-ABL dương tính, hoặc nhiễm sắc thể Ph âm tính nhưng gen dung hợp BCR-ABL dương tính. Đồng thời phải kết hợp một trong các yếu tố sau: ① Bạch cầu máu ngoại vi tăng cao, chủ yếu là bạch cầu đa nhân trung tính, bạch cầu hạt chưa trưởng thành> 10%, tế bào nguyên thủy (týp I + II) <10%. ②Tăng sản tuỷ xương rõ rệt đối với các tế bào cực kỳ hoạt động, chủ yếu là bạch cầu đa nhân trung tính và bạch cầu đa nhân trung tính ở giai đoạn dưới, tế bào nguyên thủy (loại Ⅰ + Ⅱ) <10%.

1. Tiêu chí giai đoạn Vì 90% CML chắc chắn sẽ bước vào giai đoạn tăng tốc sau một thời gian trung bình khoảng 3 năm trong giai đoạn mãn tính, và cuối cùng phát triển thêm đến giai đoạn bùng phát, kết thúc trong bệnh bạch cầu cấp tính, vì vậy cần hiểu rõ đặc điểm của từng giai đoạn. Sau đây mô tả các tiêu chuẩn phân kỳ hiện đang được áp dụng ở Trung Quốc.
(1) Giai đoạn mãn tính:
① Biểu hiện lâm sàng: không có triệu chứng hoặc chỉ sốt nhẹ, mệt mỏi, vã mồ hôi, sụt cân và các triệu chứng khác.
② Hình ảnh bạch cầu: số lượng bạch cầu tăng, chủ yếu là bạch cầu hạt trung tính, trung niên, hình que và phân thùy, tế bào nguyên thủy (loại Ⅰ + Ⅱ) <10%, basophils và bạch cầu ái toan tăng, và một lượng nhỏ ngây thơ Hồng cầu.
③ Hình ảnh tuỷ xương: tăng sản rõ rệt đến tăng sản cực mạnh, chủ yếu là tăng sản dạng hạt. Các tế bào hạt ở giữa và cuối trẻ và hình que tăng lên, và các tế bào ban đầu (loại Ⅰ + Ⅱ) ít hơn 10%.
Nhiễm sắc thể ④Ph và (hoặc) gen dung hợp BCR-ABL dương tính.
⑤ Nuôi cấy CFU-GM ở máu ngoại vi: số lượng khuẩn lạc và cụm cao hơn bình thường có ý nghĩa.
(2) Những người có bất kỳ 2 mục nào sau đây trong giai đoạn cấp tốc có thể được chẩn đoán.
① Sốt không rõ nguyên nhân, thiếu máu, chảy máu ngày càng nặng và / hoặc đau xương.
② Lá lách to dần.
③ Giảm hoặc tăng dần tiểu cầu do không dùng thuốc.
④ Bạch cầu máu ngoại vi> 20%.
⑤ Máu ngoại vi và / hoặc tủy xương (loại Ⅰ + Ⅱ) ≥10%, nhưng <20%.
⑥ Có sự tăng sinh đáng kể của các sợi collagen trong bệnh lý tủy xương.
⑦ Xuất hiện các bất thường về nhiễm sắc thể khác với nhiễm sắc thể Ph (số 8, 17, 19 và 22 là phổ biến nhất).
⑧ Điều trị bằng thuốc chống CGL truyền thống không thành công.
⑨CFU-GM tăng sinh và khiếm khuyết biệt hóa, tăng cụm và tỷ lệ cụm / khuẩn lạc tăng.
(3) Những người có bất kỳ dấu hiệu nào sau đây trong giai đoạn bùng nổ có thể được chẩn đoán.
① Trong máu ngoại vi hoặc tủy xương, các tế bào nguyên thủy (loại Ⅰ + Ⅱ), hoặc tế bào lympho nguyên thủy + ngây thơ, hoặc tế bào đơn nguyên thủy + nguyên thủy ≥ 20%.
②Bổ máu ngoại vi (loại Ⅰ + Ⅱ) + tế bào tiền tủy bào ≥ 30%.
③Bùng tủy (type Ⅰ + Ⅱ) + tế bào tiền bào ≥50%.
④ Xâm nhập tế bào nguyên thủy ngoại tủy.
Năm 1987, tiêu chuẩn phân giai đoạn của Nhóm đăng ký cấy ghép tủy xương quốc tế gần giống với tiêu chuẩn trong nước.
2. Biến thể CML
(1) Bệnh bạch cầu đa nhân trung tính mãn tính (CNL): Bệnh nhân âm tính với nhiễm sắc thể Ph và âm tính với gen dung hợp BCR-ABL. Các biểu hiện lâm sàng và thay đổi huyết học của ANL cũng khác với CML điển hình. Bệnh nhân thường chỉ phì đại nhẹ lá lách; mức tăng bạch cầu máu ngoại vi là (30-50) × 109 / L, hầu hết là điểm trung tính trưởng thành. Tế bào nhân lá và tế bào ưa bazơ thường không tăng, và điểm nhuộm ALP tăng; tủy xương cũng bị chi phối bởi bạch cầu trung tính trưởng thành và diễn biến bệnh gần giống như CGL. Năm 2001, sơ đồ phân loại mới của u tủy WH0 đã phân loại CNL vào các bệnh tăng sinh tủy , thay vì CML.
(2) Bệnh bạch cầu myelomonocytic mãn tính (CMML): Bệnh nhân âm tính với nhiễm sắc thể Ph và âm tính với gen dung hợp BCR-ABL. Các thay đổi về lâm sàng và huyết học cũng khác so với CML điển hình, lá lách của bệnh nhân thường không to hoặc chỉ hơi to; sự gia tăng bạch cầu máu ngoại vi tương đối thấp, hiếm khi> 100 × 109 / L. Bạch cầu trung tính chưa trưởng thành <5> 1 × 109 / L; bạch cầu hạt tăng sinh rõ ràng trong tủy xương, bạch cầu đơn nhân trưởng thành cũng tăng nhẹ, tỷ lệ hồng cầu chưa trưởng thành thường> 15%, nhưng mỗi dòng về cơ bản không có bệnh lý tạo máu, hoặc rất nhẹ; Diễn tiến bệnh nhanh hơn CGL, hiệu quả điều trị kém. Năm 2001, phân loại u tủy của WHO đã phân loại CMML là bệnh u tủy bào / bệnh u tủy xương (MD / MPD).
(3) CML vị thành niên (juvenlile CML, jCML): DML xảy ra ở thanh thiếu niên, hầu hết giống CML điển hình về biểu hiện lâm sàng, thay đổi huyết học và di truyền tế bào, nhưng bệnh tương tự xảy ra ở người trẻ. Nhưng một loại CML vị thành niên khác là một bệnh khác với CML điển hình: ① Nhiễm sắc thể Ph của nó âm tính, gen dung hợp BCR-ABL cũng âm tính và không có bất thường nhiễm sắc thể nào khác. ② Tổn thương da dạng tế bào là phổ biến và bệnh tiến triển nhanh chóng, tương tự như bệnh bạch cầu dòng tủy cấp tính (AML). ③ Tế bào hạt của tủy xương và các dòng tế bào đơn nhân tăng sinh cùng lúc, và các tế bào nguyên thủy có kích thước <20 juvenile = “” mohocytic = “” leukemia = “” cml = “”> 1 × 109 / L. ⑤Đặc điểm là điện di huyết sắc tố cho thấy 50% bệnh nhân có HbF tăng, HbA2 giảm, hàm lượng anhydrase carbonic trong hồng cầu giảm. ⑥ Tiểu cầu thường giảm, và các megakaryocytes của tủy xương cũng giảm theo.
CML với các đặc điểm trên được gọi là jCML. Nó rất giống với hội chứng gamma đơn phân, nhưng kiểm tra nhiễm sắc thể có thể xác định nó. Trong sơ đồ phân loại mới của WHO ở trên, jCML đã được phân loại là MD / MPD.
(4) CML không điển hình (Atypical CML, aCML): aCML và CML điển hình có những bất thường giống nhau khi khám lâm sàng và xét nghiệm, nhưng mức độ nhẹ nên được gọi là aCML (bao gồm lách to, bạch cầu tăng). Biên độ cao, tỷ lệ bạch cầu trung tính chưa trưởng thành và số lượng basophils). Ngoài ra, aCML thường bị thiếu máu, tăng nhẹ tế bào đơn nhân máu ngoại vi, chỉ số ALP tăng cao ở một phần ba số bệnh nhân và một số lượng tương đối lớn các tế bào hồng cầu tủy xương, và kèm theo đó là bệnh đa dòng máu tạo máu. Nó thường kết thúc bằng suy tủy xương khi bệnh tiến triển. Những thay đổi cấp tính là rất hiếm. Sự khác biệt chính giữa aCML và CML điển hình là nhiễm sắc thể Ph và gen dung hợp BCR-ABL của nó đều âm tính và các bất thường nhiễm sắc thể khác thường gặp. Ví dụ, tiên lượng của tam nhiễm sắc thể 8 xấu hơn đáng kể so với CGL và thời gian sống trung bình chỉ từ 1 đến 1,5 năm. Trong sơ đồ phân loại mới của WHO ở trên, aCML cũng đã được phân loại là MD / MPD.
3. Phân dàn theo yếu tố tiên lượng: Một số học giả nước ngoài đã đưa ra một số tiêu chuẩn dàn dựa trên yếu tố tiên lượng xấu hoặc kết quả tính toán của phương trình hồi quy.
Phân nhóm: Mặc dù một số mô hình phân nhóm đã được đề xuất, cho đến nay nó đã được công nhận nhiều hơn trong CMI quốc tế bởi Sokal và cộng sự (1984). Công thức nguy cơ tương đối do nhóm nghiên cứu tiên lượng đề xuất:
Nam là 1 và nữ là 2, và hematocrit được tính bằng%. Theo công thức trên để tính giá trị nguy cơ tương đối, bệnh nhân CML có thể được chia thành các nhóm nguy cơ thấp (<0 8 = “” 0 = “” 8 = “” 1 = “” 2 = “”> 1,2).
Vì công thức trên chủ yếu được suy ra dựa trên những bệnh nhân có hóa trị liệu thông thường (chủ yếu là busulfan và hydroxyurea), nên giá trị cho những bệnh nhân được điều trị bằng IFN-α là tương đối kém. Gần đây, Hasford và cộng sự đã đề xuất một hệ thống tính điểm mới dựa trên dữ liệu của 1.300 bệnh nhân được điều trị bằng IFN-α.
Chẩn đoán và đánh giá: Trong các trường hợp lâm sàng, những bệnh nhân có lách to không rõ nguyên nhân, đau xương ức, số lượng bạch cầu ngoại vi tăng đáng kể, và / hoặc basophils và bạch cầu ái toan nên cảnh giác với sự hiện diện của CML và lấy mẫu máu kịp thời. Cẩn thận quan sát hình thái của tế bào nhân, nếu xuất hiện một số lượng nhất định bạch cầu và bạch cầu trung tính, sau khi loại trừ phản ứng giống bệnh bạch cầu thì có thể chẩn đoán sơ bộ về CML. Do đó, việc chú ý đến khám lâm sàng và kiểm tra máu định kỳ có thể cung cấp những thông tin vô cùng quý giá cho việc chẩn đoán CML.
Chọc hút tủy xương cho thấy tăng sản rõ ràng hoặc cực kỳ tích cực, và chủ yếu là bạch cầu hạt, chủ yếu là bạch cầu trung tính và bạch cầu trung tính ở giai đoạn sau, về cơ bản có thể được chẩn đoán là CML. Theo tiêu chuẩn quốc tế, chẩn đoán CML cần có bằng chứng về di truyền tế bào và / hoặc sinh học phân tử, tức là phát hiện nhiễm sắc thể Ph và / hoặc gen dung hợp BCR-ABL, hoặc ít nhất là phát hiện protein dung hợp BCR-ABL được biểu hiện bởi gen sau. Đặc biệt trong các trường hợp không điển hình về lâm sàng hoặc huyết học, cần thực hiện xét nghiệm này để nâng cao trình độ chẩn đoán và chẩn đoán phân biệt.
Các hạng mục kiểm tra: phân tích hình ảnh tủy xương, xét nghiệm máu, nhuộm phosphatase kiềm
1. Giai đoạn mãn tính
(1) Hình ảnh máu: Số lượng bạch cầu thường> 50 × 109 / L và đôi khi có thể lên đến hơn 500 × 109 / L. Khoảng một phần ba bệnh nhân có hemoglobin <110g / L, và phần lớn thiếu máu là tế bào bình thường tế bào bình thường. Tiểu cầu thường tăng, đôi khi cao tới 1000 × 109 / L và một số ít bệnh nhân có thể giảm bình thường. Khi xét nghiệm lam máu, có thể thấy bạch cầu hạt ở các giai đoạn trưởng thành khác nhau, phần lớn ở giai đoạn giữa và cuối của nguyên bào tủy. Tế bào nguyên liệu <5%, bạch cầu hạt nguyên sinh + tế bào nhân sơ ≤10%, tăng bạch cầu ái toan và ưa bazơ, và một lượng nhỏ hồng cầu có nhân.
(2) Hiện tượng tủy xương: tăng sản cực kỳ hoạt động hoặc rõ ràng là hoạt động, với chuỗi hạt là trọng tâm, tỷ lệ hạt trên màu đỏ có thể tăng lên 10: 1 ~ 20: 1, dòng hạt tăng trong tất cả các giai đoạn, và tế bào tủy giữa và cuối tăng Chủ yếu. Tỷ lệ bạch cầu ái toan so với basophils cao hơn đáng kể so với bình thường, và bạch cầu megakaryocytes và tiểu cầu cũng tăng lên.
(3) Phosphatase kiềm của bạch cầu trung tính (ALP): Điểm nhuộm giảm hoặc về gần bằng không.
(4) Kiểm tra di truyền tế bào và sinh học phân tử: hơn 90% bệnh nhân có tế bào chuyển hóa tủy xương giai đoạn mãn tính thường có nhiễm sắc thể Ph dương tính, và kỹ thuật tạo dải chứng minh rằng nhánh dài của nhiễm sắc thể số 9 có 3 vùng 4 dải và nhiễm sắc thể 22 1 vùng 1 vùng 1 phân mảnh. Chuyển vị lẫn nhau, cụ thể là t (9; 22) (q34; 11). Lai tại chỗ nhiễm sắc thể fluorescein (FISH) nhạy hơn. DNA từ tủy xương hoặc tế bào đơn nhân máu ngoại vi được chiết xuất, và sự sắp xếp lại gen bcr có thể được phát hiện bằng phương pháp Southern blotting, xảy ra ở đầu 5 ‘(b3a2). Nếu chiết xuất RNA từ tủy xương hoặc tế bào đơn nhân máu, phản ứng chuỗi polymerase phiên mã ngược (RT-PCR) có thể phát hiện mRNA sản phẩm phiên mã bcr / abl, đây là phương pháp đặc hiệu và nhạy nhất hiện nay.
(5) Xác định sinh hóa huyết thanh: acid uric huyết thanh, lactate dehydrogenase và lysozyme có xu hướng tăng.
2. Thiếu máu trong giai đoạn blast xấu đi nhanh chóng, và các tế bào blast trong tủy xương và máu ngoại vi tăng lên đáng kể. Bùng nổ tuỷ xương ≥20%, nếu là cơn cấp tính có thể tới trên 90%, giảm tiểu cầu , phosphatase kiềm tế bào nhân trung tính có thể tăng cao hoặc bình thường, xét nghiệm di truyền, thường dị bội. Addition Ngoài nhiễm sắc thể Ph của t (9; 22) (q341; q11), còn có các bất thường nhiễm sắc thể khác, chẳng hạn như nhiễm sắc thể Ph thứ hai, hoặc một nhiễm sắc thể 8 (+8), hoặc chiều dài của nhiễm sắc thể 17 Sự vắng mặt của đẳng áp cánh tay (ISO17q-).
3. Các tế bào bạch cầu tiếp tục tăng trong giai đoạn tăng tốc, và các tế bào chưa trưởng thành bắt đầu tăng lên, hạt ban đầu + promyelocytic ≥ 10%.
1. Nhuộm bạc các phần bệnh lý của sinh thiết tủy xương thường cho thấy tăng sản sợi lưới, và khoảng một nửa số bệnh nhân có tăng sản đáng kể.
2. Tùy theo tình trạng, triệu chứng và dấu hiệu, chọn làm X-quang, CT, MRI, siêu âm B, điện tâm đồ và các khám khác.
1. Trong các điều kiện không điển hình, CML cần được phân biệt với các phản ứng giống bệnh bạch cầu. Các phản ứng giống bệnh bạch cầu có thể là thứ phát sau sốc, nhiễm trùng nặng, bệnh lao, khối u tiến triển hoặc giai đoạn giữa và cuối của thai kỳ. Số lượng bạch cầu hầu hết dưới 50 × 109 / L, bạch cầu trung tính Điểm nhuộm phosphatase kiềm tế bào thường tăng cao, không có bất thường về nhiễm sắc thể Ph và gen dung hợp bcr / abl, bạch cầu có thể trở lại bình thường sau khi bệnh nguyên phát được kiểm soát. Vẫn cần phân biệt với bệnh xơ tủy nguyên phát (MF). MF thường có biểu hiện lách to rõ ràng , bạch cầu và tiểu cầu có thể tăng, ấu trùng và hồng cầu non xuất hiện trong các lát máu, rất dễ nhầm với CML. Tuy nhiên, nhiễm sắc thể Ph của bệnh nhân MF âm tính, các sợi lưới và sợi collagen tăng sinh trong sinh thiết tủy xương.
2.Ph dương tính ALL và không cần giai đoạn mãn tính của CML , sự khác biệt ngụy trang nguyên bào lympho cấp tính giữa các biểu hiện lâm sàng tương tự, rõ ràng là lách to, Ph dương tính ALL khi thuyên giảm hoàn toàn trở lại karyotype bình thường, tái phát sinh sản. Khó loại trừ nhiễm sắc thể Ph ở những bệnh nhân CML chuyển dạng tế bào lympho cấp tính, và có thêm bất thường nhiễm sắc thể . Từ việc phát hiện mức độ phân tử, có thể thấy rằng khoảng một nửa số gen dung hợp PH dương tính ALL và các sản phẩm biểu hiện của chúng giống như CML. Điểm phá vỡ nằm ở M-bcr và tích bcr / abl của nó là p210. Điểm đứt của nửa còn lại của PH dương tính ALL nằm trong vùng M-bcr khoảng 40 kb ngược dòng M-bcr, và sản phẩm protein là p190. Khi làm xét nghiệm di truyền, cần có các mồi và mẫu dò khác với CML dương tính với Ph để phân biệt với CML.
3. CML cần được phân biệt với một số bệnh liên quan của CML ban đầu vì tất cả chúng đều có tăng số lượng bạch cầu ngoại vi và bạch cầu hạt chưa trưởng thành; tăng sản tủy xương rõ ràng hoặc cực kỳ hoạt động, chủ yếu là bạch cầu hạt; thường kèm theo lách to, v.v. Dấu hiệu. Điểm mấu chốt trong việc phân biệt CML với các bệnh liên quan này là phát hiện nhiễm sắc thể Ph và gen dung hợp bcr / abl. CML là dương tính, trong khi các bệnh liên quan là âm tính. Sau đây liệt kê ngắn gọn các điểm nhận dạng chính khác.
(1) Bệnh bạch cầu trung tính mãn tính (CNL): Các tế bào tăng sinh trong tủy xương chủ yếu là các tế bào nhân trung tính trưởng thành, và điểm nhuộm phosphatase kiềm (ALP) của bạch cầu trung tính máu ngoại vi thường tăng lên. Hiện nay, CNL đã được xếp vào nhóm bệnh tăng sinh tủy theo phân loại của WHO .
(2) CML không điển hình (aCML): Về bản chất, nó là một căn bệnh hoàn toàn khác với CML điển hình, và cách đặt tên của nó cũng không phù hợp. aCML bị thiếu máu và giảm tiểu cầu trong giai đoạn đầu của bệnh , bạch cầu tăng ít hoặc không tăng; máu ngoại vi rất ít hoặc không có; tủy xương thường có một hoặc nhiều dòng tạo máu bệnh lý; lách to không đáng kể; thường muộn. Biểu hiện suy tủy xương, diễn biến cấp tính <50%.
(3) Bệnh bạch cầu myelomonocytic mãn tính (CMML): CMML thuộc hội chứng rối loạn sinh tủy (MDS) trong phân loại FAB ban đầu có tạo máu bệnh lý rõ ràng và tăng nổ (RAEB), kèm theo các tế bào đơn nhân máu ngoại vi> 1 × 109 / L, không dễ bị nhầm lẫn với CML. Một loại khác được gọi là CMML tăng sinh cần được xác định cẩn thận Ngoài nhiễm sắc thể Ph nói trên và gen dung hợp bcr / abl âm tính, các tế bào đơn nhân máu ngoại vi> 1 × 109 / L là những điểm chính để nhận dạng.
(4) Bệnh bạch cầu nguyên bào tủy vị thành niên (JMML): Đây là một bệnh bạch cầu dòng tủy mạn tính rất hiếm gặp ở trẻ em, về mặt lâm sàng thường kèm theo sốt , thiếu máu, đặc biệt là với các tổn thương da, chẳng hạn như phát ban dát sẩn ở mặt , xanthoma và đốm cà phê sữa . Tế bào đơn nhân trong máu ngoại vi> 1 × 109 / L là những điểm chính để phân biệt với CML. Các aCML, CMMIL và JMML nêu trên được xếp vào loại hội chứng loạn sản tủy / bệnh rối loạn sinh tủy (MDS / MPD) trong phân loại của WHO.
1. Thuyên tắc lá lách , vỡ lách và chảy máu lách có thể xảy ra ở một số bệnh nhân trong giai đoạn mãn tính .
2. Giai đoạn bùng nổ tăng tốc có thể phức tạp do nhiễm trùng, sốt , bệnh tim thiếu máu , suy tim và các biến chứng khác. Viêm khớp gút cấp tính có thể phức tạp do cản trở lưu lượng máu trong các mạch máu lưu thông của phổi, hệ thần kinh trung ương, một số cơ quan cảm giác đặc biệt và dương vật, và các triệu chứng và dấu hiệu tương ứng, chẳng hạn như khó thở , khó thở , tím tái, chóng mặt , nói lắp, v.v. Mê sảng , hôn mê , mờ mắt, ù tai , giảm thính lực và chứng choáng váng .
Xem thêm
Bệnh angiosarcoma âm đạo là gì? Những thông tin cần biết
Bệnh Astrocytoma là gì? Nguyên nhân, triệu chứng và cách điều trị
Tránh hoặc giảm tiếp xúc với các chất độc hại như chất phóng xạ, chất hóa học và thuốc hóa học.
Tổng điều tra thường xuyên nên được thực hiện cho những người có nguy cơ cao của bệnh bạch cầu , đặc biệt chú ý đến cảnh báo bệnh bạch cầu và các triệu chứng sớm. Những ai có điều kiện có thể uống Nguồn Sinh Lực Tianxian để điều trị dự phòng.
Ăn nhiều thực phẩm tự nhiên hơn và thực phẩm được sản xuất chính thức đã qua kiểm tra vệ sinh, chẳng hạn như rau tươi, ngũ cốc nguyên hạt, v.v.

Hiệu quả điều trị của CML bao gồm thuyên giảm huyết học, thuyên giảm di truyền tế bào (nghĩa là tỷ lệ biến mất tế bào Ph) và thuyên giảm phân tử (nghĩa là tỷ lệ chuyển đổi gen dung hợp BCR-ABL), vì ba mức độ thuyên giảm khác nhau này có liên quan đến sự sống sót của bệnh nhân CML Giai đoạn này có liên quan đáng kể, vì vậy mục đích chính của điều trị CML hiện đại là làm thế nào để cải thiện tỷ lệ thuyên giảm của hai giai đoạn sau và cố gắng giúp bệnh nhân có được thời gian sống sót không mắc bệnh lâu dài.
1. Điều trị thông thường CML thường bị tăng acid uric máu khi đi khám bệnh hoặc tái phát. Vì vậy, trước khi điều trị, nên cho allopurinol 300mg / ngày uống và truyền đủ nước để duy trì lượng nước tiểu; nếu bệnh nhân có nhiều yếu tố nguy cơ ly giải tế bào thì dùng allopurin Liều lượng rượu và tần suất sử dụng nên được tăng lên, và duy trì lượng nước tiểu ở mức 150ml / h. Vì allopurinol có thể gây viêm da dị ứng , nên ngừng dùng thuốc sau khi số lượng bạch cầu giảm xuống bình thường, lách to đã giảm đáng kể và không có tăng acid uric máu rõ rệt.
(1) Busulfan (Ma Lilan): là loại thuốc hóa trị đầu tiên được sử dụng rộng rãi trong điều trị CML. Hiệu quả của nó đã được xác nhận bằng cách so sánh ngẫu nhiên vào năm 1968. Liều thông thường là 4-6mg / ngày, uống. Do thuốc có tác dụng rõ ràng sau khi số lượng bạch cầu giảm xuống khoảng 30 × 109 / L, nên giảm liều hoặc ngừng thuốc. Hầu hết bệnh nhân cần điều trị duy trì. Có thể giảm liều duy trì xuống 2 mg, uống, hai lần một tuần. Khoảng 95% bệnh nhân ở giai đoạn mãn tính có hiệu quả. Bạch cầu giảm, lách co, hematocrit tăng và tình trạng chung trở lại bình thường.
Điều trị bằng Busulfan (Ma Lilan) thường không làm cho nhiễm sắc thể Ph biến mất. Mục đích của điều trị bằng Busulfan (Ma Lilan) là kiểm soát giai đoạn mãn tính và giảm tỷ lệ tử vong.
Các tác dụng phụ chính của thuốc là ức chế tủy xương nghiêm trọng , mất sắc tố da, mệt mỏi , sốt và tiêu chảy, tương tự như hội chứng suy thượng thận và xơ phổi .
(2) Hydroxyurea: Năm 1993, người ta đã chứng minh rằng hydroxyurea (HU) vượt trội hơn Busulfan (Marilan) thông qua một loạt các so sánh ngẫu nhiên. Thời gian sống trung bình của nhóm bị xóa tốt hơn đáng kể so với nhóm BUS (lần lượt là 58 tháng và 45 tháng), và tỷ lệ sống sót sau 5 năm tương ứng là 44% và 32%. Do độc tính thấp, nó có thể kéo dài giai đoạn mãn tính của CML và có lợi cho bệnh nhân để ghép tế bào gốc tạo máu . Nó đã trở thành lựa chọn hàng đầu cho hóa trị liệu cho CML. Theo số lượng bạch cầu, liều ban đầu là 1 ~ 4g / ngày, uống; khi bạch cầu giảm xuống 20 × 109 / L, nó được thay đổi thành 1 ~ 2g / ngày, và liều duy trì là 0,5 ~ 2,0g / ngày; khi số lượng bạch cầu giảm xuống 5 × 109 / L nên bị đình chỉ. HU có tác dụng phụ nhẹ như sẩn da , thay đổi nguyên bào khổng lồ trong tế bào tủy xương, tăng tế bào vĩ mô , tăng lưu lượng kinh nguyệt, hói đầu, v.v., nhưng ít ức chế tủy xương và không có xơ phổi. Một số bệnh nhân có thể bị giảm tỷ lệ dương tính với nhiễm sắc thể Ph. Các nghiên cứu gần đây đã phát hiện ra rằng hydroxyurea (HU) có thể trì hoãn sự xuất hiện của xơ hóa tủy xương ở bệnh nhân CML và có tác dụng đảo ngược đối với bệnh nhân xơ hóa nhẹ sớm.
(3) Indirubin và các dẫn xuất meisoindigo: Indirubin và meisoindigo là thuốc mới đầu tiên trong điều trị CNL của Viện Huyết học, Viện Khoa học Y khoa Trung Quốc sau hơn 20 năm nghiên cứu. Dùng indirubin một lần 100-300mg / ngày, chia 3 đến 4 lần uống, tổng tỷ lệ hiệu quả là 95,8%. Dùng meisoindigo một lần 75-150mg / ngày, uống chia 3 lần, tổng tỷ lệ thuyên giảm là 80,6%. So với BUS và HU, tác dụng thu nhỏ lá lách của nó tốt hơn đáng kể so với trước đây. Gần đây, các nghiên cứu đã xác nhận rằng hiệu quả lâu dài của meisoindigo tương tự như HU, sự kết hợp giữa meisoindigo và hydroxyurea (HU) có thể kéo dài đáng kể giai đoạn mãn tính của bệnh nhân và giảm tỷ lệ bệnh đạo ôn kéo dài 5 năm. Một số bệnh nhân có thể bị giảm tỷ lệ dương tính với nhiễm sắc thể Ph. Các tác dụng phụ chính là đau xương và khớp ở nhiều mức độ khác nhau , buồn nôn , chán ăn, đau bụng, tiêu chảy và các phản ứng đường tiêu hóa khác, và ức chế tủy xương hiếm khi được thấy trong quá trình điều trị.
(4) Những loại khác: Có cyclophosphamide dùng một lần, mercaptopurine (6-mercaptopurine), oxfenarsine (melphalan), chlorambucil (liukening), dibromomannitol, urafidine ( 520), colchicamine, dibromodulcol, carboquinone, harringtonine và các phương pháp điều trị khác cho bệnh nhân CML mãn tính. Mặc dù những loại thuốc này có hiệu quả với CML nhưng không loại thuốc nào có tác dụng tốt hơn BUS hoặc HU. Gần đây, một đợt điều trị dài ngày với homoharringtonine 2,5mg / (m2 · d), truyền tĩnh mạch, vào ngày đầu tiên đến ngày thứ 14, đã báo cáo rằng 6% bệnh nhân CML thuyên giảm hoàn toàn về di truyền tế bào.
Năm 1983, Talpaz và cộng sự báo cáo rằng 51 trường hợp bệnh nhân CML CP được điều trị bằng interferon tự nhiên (IFN) đơn thuần, trong đó 71% (36 trường hợp) thuyên giảm huyết học, và 7 trường hợp (14%) nhiễm sắc thể Ph biến mất. Kể từ đó, các quan sát về hiệu quả của interferon tự nhiên và tái tổ hợp trong điều trị CML cho thấy tỷ lệ thuyên giảm huyết học là 61% đến 80% (trung bình 64%), và 29% đến 65% bệnh nhân có mức độ thuyên giảm di truyền tế bào khác nhau, hiện đã trở thành CML Sự lựa chọn điều trị.
Mặc dù cho đến nay đã đạt được một số đồng thuận về việc điều trị interferon (IFN) cho CML: ① Interferon tự nhiên và interferon tái tổ hợp của người có tác dụng tương tự trong điều trị CML; ② Dùng thuốc liên tục tốt hơn dùng thuốc ngắt quãng và liều lượng lớn tốt hơn liều lượng nhỏ. Máu của những trường hợp mới điều trị Sự thuyên giảm hoàn toàn về mặt lâm sàng cao hơn đáng kể so với những bệnh nhân đang điều trị, và hiệu quả trong giai đoạn tăng tốc kém hơn ở giai đoạn mãn tính; ③ Tiêm bắp hoặc tiêm dưới da tốt hơn tiêm tĩnh mạch. Tuy nhiên, vẫn còn nhiều vấn đề cần giải quyết: A. Liệu interferon (IFN) có thể kéo dài thời gian sống sót cho bệnh nhân CML hay không: Kết quả của một loạt nghiên cứu ngẫu nhiên có đối chứng về interferon (IFN) trong điều trị CML được công bố gần đây là không thống nhất, nhóm hợp tác Ý và MCR của Anh Kết quả cho thấy nhóm điều trị interferon (IFN) có thời gian sống lâu hơn đáng kể so với nhóm điều trị hydroxyurea (HU) (hoặc busulfan (BUS)), và có sự khác biệt đáng kể giữa hai nhóm, trong khi nhóm nghiên cứu CML của Đức phát hiện ra rằng khả năng sống sót của cả hai Không có sự khác biệt về thời kỳ (Bảng 2); B. Liều lượng và thời gian sử dụng interferon (IFN) tối ưu: Chưa có sự thống nhất, nhưng nói chung liều khởi đầu của interferon (IFN) nên là 5MU / (m2 · d ), sau 2 đến 3 tuần, liều tăng lên 9-12 MU / ngày, hoặc để đạt được hiệu quả huyết học đáng kể [tức là số lượng bạch cầu (2 ~ 4) × 109 / L, số lượng tiểu cầu gần 50 × 109 / L] dung nạp tối đa Cần giảm lượng và các triệu chứng nhiễm độc ở bệnh nhân. Thời gian thuyên giảm di truyền tế bào ngắn nhất có thể là 6 tháng và thường được sử dụng cho đến khi bệnh tiến triển hoặc không dung nạp được độc tính của thuốc; C. Mối quan hệ giữa loại interferon (IFN) và tác dụng chữa bệnh: Người ta thường coi các loại Không có sự khác biệt về hiệu quả lâm sàng của interferon a và hiệu quả của interferon γ chưa rõ ràng. Interferon α kết hợp với interferon γ không thể cải thiện hiệu quả; D. Interferon (IFN) kết hợp với các thuốc hóa trị khác như hydroxyurea, cytarabine liều thấp 20mg / ( m2 · d) × 10 ngày đã được quan sát lâm sàng trong giai đoạn II, cho thấy hiệu quả điều trị tốt hơn IFN đơn thuần.
Các tác dụng phụ ban đầu thường gặp khi điều trị CML bằng interferon (IFN) bao gồm sốt, ớn lạnh, các triệu chứng giống cúm, nhức đầu, v.v., kéo dài trong khoảng vài ngày đến 2 tháng; có thể mệt mỏi dai dẳng, chán ăn và sụt cân ở giai đoạn cuối và một số trường hợp có thể bị Thiếu máu, giảm tiểu cầu, tổn thương gan và thận, hói đầu, và đôi khi đau xương và cơ, suy giáp, trầm cảm, … Trong trường hợp nặng, có thể bị đau thắt ngực , kém tập trung, mất trí nhớ và hôn mê. Các triệu chứng trên có thể thuyên giảm hoặc biến mất khi giảm liều, và các tác dụng phụ trên có thể thuyên giảm bằng cách cho uống một liều nhỏ thuốc giảm đau hạ sốt như acetaminophen (paracetamol).
Vào tháng 6 năm 1998, Imatinib (STl57l) (còn được gọi là CGP57148 hoặc Gleevec) bắt đầu thử nghiệm lâm sàng giai đoạn I. Tổng số 83 bệnh nhân mắc CML mãn tính đã thất bại với liệu pháp interferon Phương pháp điều trị được chia thành 14 nhóm liều theo 25 ~ 1000mg / ngày. Kết quả khẳng định rằng liều thấp nhất để đạt được hiệu quả lâm sàng tối đa là 300mg / ngày. Trong số 54 bệnh nhân dùng liều 300mg / ngày trở lên, 53 bệnh nhân (98%) hoàn toàn Sự thuyên giảm huyết học, 31% bệnh nhân đạt được sự thuyên giảm đáng kể về di truyền tế bào. Được khuyến khích bởi kết quả này, 58 bệnh nhân bị thay đổi dạng hạt mãn tính hoặc bệnh bạch cầu cấp tính Ph được điều trị với liều 300-1000 mg / ngày, 55% (21/38 trường hợp) CML thay đổi đột ngột và 70% (14/20 trường hợp) CML Bệnh nhân Ph ALL đã thu được các hiệu ứng huyết học. Sau đó, 454 trường hợp CP CML, 181 trường hợp AP CML và 229 trường hợp u hạt cấp tính CML bước vào thử nghiệm lâm sàng giai đoạn 2. Tỷ lệ thuyên giảm hoàn toàn về huyết học lần lượt là 91%, 69% và 29% và tỷ lệ thuyên giảm đáng kể về di truyền tế bào là 55%, 24% và 16%. Thuốc được FDA Hoa Kỳ phê duyệt ngày 10/5/2001, hiện đang được thử nghiệm lâm sàng giai đoạn III trên toàn thế giới.
Cơ chế hoạt động của imatinib (ST1571) là ức chế hoạt động tyrosine kinase của gen dung hợp BCR-ABL. Cho đến nay, liều lượng imatinib tối ưu trên lâm sàng (STl571) chưa được rõ ràng lắm. Liều khởi đầu khuyến cáo của CP CML là 400mg / ngày và liều khởi đầu khuyến cáo cho giai đoạn tăng tốc (giai đoạn blastic) là 600mg / ngày. Những bệnh nhân không hiệu quả có thể Tăng lên 800mg / ngày. Vì imatinib (STl571) có thời gian bán hủy từ 14 đến 16 giờ, nên một liều mỗi ngày là đủ. Các tác dụng phụ chính là ức chế tủy xương, buồn nôn, chuột rút cơ, đau xương, đau khớp , phát ban da, tiêu chảy, phù nề, giữ nước và tổn thương gan.
sử dụng cytarabine, anthracyclines, thioguanine (6-TG), cyclophosphamide, asparaginase, mercaptopurine (6-MP), etoposide (VP-16) và Busulfan (Ma Lilan) và các loại thuốc khác được kết hợp với các phác đồ hóa trị chuyên sâu khác nhau để điều trị CML, và tỷ lệ giảm nhiễm sắc thể Ph cao hơn so với liệu pháp đơn chất thông thường. Tuy nhiên, hầu hết các nghiên cứu đã chỉ ra rằng thời gian sống sót không thể kéo dài đáng kể (Bảng 3). Gần đây, người ta sử dụng kết hợp hóa trị và interferon một liệu pháp để cố gắng cải thiện tỷ lệ sống sót và tỷ lệ thuyên giảm di truyền tế bào, nhưng kết quả cho đến nay vẫn chưa khả quan.
(1) Cấy ghép tế bào gốc tự thân (ASCT): Kết quả ASCT cho bệnh nhân CP CML cho thấy ASCT thanh lọc tế bào gốc trong CP có thể kéo dài đáng kể thời gian sống sót của CML.
Trong những năm gần đây, người ta sử dụng phương pháp hóa trị kết hợp để huy động tế bào gốc Ph-ngoại vi, interferon alpha đơn thuần hoặc kết hợp với hydroxyurea để điều trị CML và các phương pháp “làm sạch in vivo” và nuôi cấy tế bào tủy xương dài hạn, các loại thuốc như 4-HC và ASTA-Z, interferon, antisense Oligonucleotide và các phương pháp “tinh sạch in vitro” khác để sàng lọc tế bào gốc máu ngoại vi Ph, mặc dù tỷ lệ chuyển đổi Ph âm tính sau khi ASCT đã được tăng lên, tỷ lệ sống sót của bệnh nhân được ghép tế bào gốc tinh khiết không được cải thiện đáng kể. Gần đây, McGlare và cộng sự đã tổng kết và phân tích tác dụng của ASCT trong điều trị CML được báo cáo bởi 8 trung tâm BMT ở Châu Âu và Hoa Kỳ. Thời gian trung bình từ khi chẩn đoán đến khi cấy ghép là 15 tháng. 123 trường hợp tế bào gốc lấy từ tủy xương, 73 trường hợp lấy từ máu ngoại vi, 21 trường hợp tủy xương được nuôi cấy và làm sạch trong ống nghiệm trong 10 ngày, 23 trường hợp tủy xương được tinh sạch bằng interferon gamma và trung vị sau khi ghép Sau khi theo dõi 48 tháng, tỷ lệ sống 5 năm của bệnh nhân được ghép CP là 95% ± 5% và ở giai đoạn AP là 27% ± 10%, tất cả bệnh nhân được ghép đều chết trong vòng 2 năm rưỡi sau khi ghép. Phân tích tiên lượng cho thấy: Tuổi> 40 và thời gian dài từ khi chẩn đoán đến khi cấy ghép là những yếu tố không thuận lợi, trong khi nguồn tế bào gốc (tủy xương hoặc máu ngoại vi) và “tinh lọc in vitro” không ảnh hưởng đến khả năng sống sót.
(2) Ghép tế bào gốc dị sinh (Allo-SCT): Cho đến nay, cấy ghép tủy xương dị sinh (Allo-BMT) là cách chữa CML duy nhất. Tỷ lệ sống sót của ghép CP tốt hơn so với AP hoặc HA, và tỷ lệ tái phát thấp hơn. Tỷ lệ sống thêm 3 năm sau khi cấy ghép CP, AP và HA lần lượt là 55% đến 70%, 10% đến 30% và 0 đến 20% và tỷ lệ tái phát lần lượt là 20%, 50% và 75%. Những bệnh nhân đã được điều trị BUS trước BMT có hiệu quả kém và tỷ lệ sống không bệnh 3 năm (DFS) là 45%, so với 61% của những người đã được điều trị HU. Điều trị IFN-a không ảnh hưởng đến hiệu quả điều trị của BMT. Các chương trình tiền xử lý khác nhau như Cy + TBI, busulfan (BUS) + Cy không ảnh hưởng đáng kể đến hiệu quả. Nguyên nhân chính của cái chết liên quan đến cấy ghép trong Allo-BMT là GVHD. Mặc dù loại bỏ tế bào T Allo-BMT có thể làm giảm tỷ lệ mắc bệnh GVHD, tỷ lệ tái phát tăng lên đáng kể, điều này cho thấy tác dụng chống bệnh bạch cầu của mảnh ghép (GVL) là một yếu tố quan trọng trong hiệu quả của Allo-BMT trong điều trị CML.
Mặc dù Allo-BMT đã đạt được kết quả khả quan trong điều trị CML, chỉ có 20% đến 25% bệnh nhân có người hiến tặng là anh chị em phù hợp với HLA. Trong những năm gần đây, nghiên cứu về điều trị CML bằng Allo-BMT từ những người hiến tặng không liên quan đã đạt được kết quả đáng mừng, DFS trong 2 năm là 31%, nhưng tỷ lệ thất bại trong ghép tạng cao tới 16%, và tỷ lệ mắc GVHD cấp III và IV là khoảng 54%. , GVHD mãn tính nặng cao tới 52%.
Các nghiên cứu gần đây đã chỉ ra rằng cấy ghép tế bào gốc máu ngoại vi dị sinh nhanh hơn Allo-BMT, hệ thống tủy và phục hồi miễn dịch sau khi cấy ghép. Hiệu quả ngắn hạn của hai phương pháp này là tương đương nhau, và hiệu quả lâu dài vẫn còn phải được xác định. Ngoài ra, cấy ghép máu cuống rốn có liên quan / không liên quan và cấy ghép tế bào gốc tạo máu không phải nguyên bào tủy cũng đã được báo cáo ban đầu.
Để hướng dẫn tốt hơn việc lựa chọn lâm sàng những bệnh nhân thích hợp để ghép tủy xương và máu ngoại vi allo, Nhóm Cấy ghép Tủy xương và Máu ngoại vi Châu Âu đã đề xuất một hệ thống điểm tiên lượng dựa trên dữ liệu của 3142 bệnh nhân (Bảng 4). Theo hệ thống tính điểm, những bệnh nhân có điểm 0, 1, 2, 3, 4, 5 và 6 có tỷ lệ sống không bệnh sau 5 năm lần lượt là 72%, 70%, 62%, 48%, 40%, 18% và 22. %, tỷ lệ tử vong liên quan đến ghép tạng là 20%, 23%, 31%, 46%, 51%, 71% và 73%.
Việc điều trị bệnh nhân tái phát sau khi cấy ghép dị nguyên bao gồm cấy ghép lần thứ hai, rIFN-α và truyền bạch cầu của người hiến tặng (DLI), có thể lấy lại CR ở khoảng 75% bệnh nhân và tỷ lệ sống sót sau 8 năm của bệnh nhân tái phát huyết học có thể đạt 60 %, tỷ lệ sống sót sau 8 năm của bệnh nhân tái phát di truyền tế bào là khoảng 80% và thời gian trung bình để đạt được hiệu quả điều trị di truyền tế bào và sinh học phân tử là 4 đến 6 tháng. Những bệnh nhân tái phát di truyền tế bào / huyết học là người đầu tiên được cấy ghép Bệnh nhân giai đoạn cận tử (CPI), thời gian lui bệnh sau ghép hơn 1 năm, không bị GVHD mãn tính sau ghép, tạo máu chimera có hiệu quả chữa bệnh tốt hơn.
Bệnh nhân biến đổi tế bào tủy cấp tính có thể được điều trị bằng AML nguyên phát, nhưng tỷ lệ CR thấp hơn 20%, và thời gian thuyên giảm hoàn toàn chỉ vài tuần hoặc vài tháng. 25% đến 35% bệnh nhân blast có thay đổi tế bào lympho cấp tính hoặc bệnh bạch cầu kiểu hai bán cầu. Mặc dù khoảng 60% bệnh nhân sử dụng VDLP có hiệu quả và khoảng 1/3 bệnh nhân có thể quay trở lại CP2, nhưng tỷ lệ sống chung chỉ là 4 đến 4. Trong vòng 6 tháng, DFS trong 3 năm của ghép tế bào gốc tạo máu có thể đạt 15% -20%.
(1) Sàng lọc và mở rộng tế bào tiền thân “lành tính”: Các thí nghiệm đã xác nhận rằng tế bào tiền thân tạo máu Ph có thể được làm giàu trong thành phần CD34 và HLA-DR của tủy xương của bệnh nhân CML, do đó, tế bào gốc không phải bệnh bạch cầu có thể được sàng lọc tương ứng. Tế bào tiền thân được sử dụng để cấy ghép sau khi mở rộng trong ống nghiệm. Một phương pháp khác là sử dụng chất nền thiếu yếu tố tế bào gốc để nuôi cấy lâu dài dựa trên các phản ứng khác nhau của tế bào “bình thường” và tế bào bệnh bạch cầu đối với cytokine, có lợi cho sự phát triển của tế bào “lành tính”. Có thể dự đoán rằng với sự cải tiến không ngừng của các phương pháp làm giàu và mở rộng, việc làm giàu tế bào Ph để cấy ghép sau khi mở rộng in vitro là một trong những hướng điều trị cho CML trong tương lai.
(2) Các oligonucleotide antisense: Các oligonucleotide Amtisense được thiết kế với BCR / ABL làm mục tiêu có thể làm giảm mức độ phiên mã của BCR / ABL và sự phát triển của các tế bào CML được nuôi cấy trong ống nghiệm (có thể bằng cách gây apoptosis ), mà hiện nay chủ yếu được sử dụng để “thanh lọc” việc cấy ghép tế bào gốc của chính CML. Đã có những báo cáo sơ bộ về việc cấy ghép tủy xương thành công và thuyên giảm một phần di truyền tế bào sau khi tinh chế trong ống nghiệm của BCR / ABL và oligonucleotide C-MYB antisense. Các oligonucleotide antisense kết hợp với các loại thuốc hóa trị liệu đã được xác nhận trong các thí nghiệm trên động vật trên chuột SCID rằng nó có thể trì hoãn đáng kể sự xuất hiện của bệnh bạch cầu.
(3) Liệu pháp gen: Đã có báo cáo về cái gọi là “chiến lược liệu pháp gen kép” kết hợp gen đối kháng BCR / ABL được xây dựng bằng vectơ retrovirus và gen kháng methotrexat (MT) X. Kết quả thí nghiệm trong ống nghiệm cho thấy điều này Phương pháp này có thể được sử dụng để tinh sạch ex vivo của cấy ghép tế bào gốc CML và hóa trị sau cấy ghép để loại bỏ tối thiểu bệnh còn sót lại.
(4) Liệu pháp điều hòa miễn dịch: Đã có báo cáo về các đoạn kết hợp P210 BCR / ABL gây miễn dịch và các peptit liên kết với phức hợp kháng nguyên hoạt động tương thích mô chính, và việc nhận biết các tế bào biểu hiện BCR / ABL cũng đã được thiết lập. Dòng tế bào T CD4 đặc hiệu với peptit, các thí nghiệm trong ống nghiệm đã xác nhận rằng việc sử dụng các tế bào T CD4 đặc hiệu với peptit có thể phân hủy các sản phẩm P210 b3a2. Những kết quả này cho thấy rằng việc nhận biết các kháng nguyên liên quan đến khối u do tế bào T của người trung gian có thể được sử dụng để điều trị CML. Ngoài ra, interleukin-2 kích hoạt tế bào NK và tế bào T gây độc tế bào có tiềm năng điều trị. Tế bào NK của chính bệnh nhân CML có thể ức chế sự phát triển của tế bào tiền thân CML. Do đó, tế bào NK tự hoạt hóa có thể được sử dụng để tinh lọc cấy ghép tế bào gốc tự thân và liệu pháp miễn dịch CML sau khi được mở rộng in vitro. Gần đây, một thí nghiệm khác phát hiện ra rằng các tế bào đuôi gai thu được từ nuôi cấy tủy xương ở bệnh nhân CML có thể kích thích tế bào của chính họ và có tác dụng chống tăng sinh, nhưng hoạt tính chống lại sự bình thường của tủy xương của chúng rất thấp, cho thấy rằng phương pháp này có thể được sử dụng cho liệu pháp miễn dịch CML.
Với sự gia tăng không ngừng của các phương pháp điều trị CML, làm thế nào để xây dựng một kế hoạch điều trị cá nhân hóa tối ưu theo điều kiện cụ thể của bệnh nhân đã trở thành một vấn đề mà mọi nhà huyết học phải đối mặt. Chế độ lựa chọn; Gần đây, Hiệp hội Huyết học Hoa Kỳ đã tổ chức các chuyên gia CML từ khắp nơi trên thế giới để phân tích chi tiết các tài liệu có giá trị hơn về điều trị CML được xuất bản cho đến nay và đề xuất hướng dẫn điều trị CML: ① Đầu tiên, theo tuổi và tình trạng thể chất của bệnh nhân, cho dù có liên quan hay không liên quan đến tủy xương Người hiến quyết định có thực hiện cấy ghép tế bào gốc hay không; ②Nếu lựa chọn kế hoạch điều trị không cấy ghép, thì nên lập kế hoạch dùng thuốc chi tiết, ví dụ với rIFN-a, phải đưa ra quyết định về liều lượng và liệu trình điều trị xem nên sử dụng hydroxyurea hay cytarabine ③ Cần xây dựng một kế hoạch có hệ thống để quan sát mức độ hiệu quả di truyền tế bào, thời điểm khởi phát và hiệu quả của sinh học phân tử; ④ Sau khi các ý kiến chẩn đoán và điều trị được làm rõ, các thay đổi liên quan đến hiệu quả điều trị và mong muốn của bệnh nhân phải được xem xét lại.
(2) Tiên lượng
Không có phương pháp dự đoán đáng tin cậy, nhưng một số lượng lớn các nghiên cứu đã xác nhận rằng tuổi, kích thước lá lách, số lượng tiểu cầu, tỷ lệ nổ trong máu ngoại vi hoặc tủy xương, và tỷ lệ basophils đều là những yếu tố ảnh hưởng đến tiên lượng. Năm 1984, Sokal đề xuất một công thức để dự đoán tỷ lệ rủi ro (RR), sử dụng tuổi (năm), lá lách (cm dưới đường giữa xương sườn), số lượng tiểu cầu (109 / L) và tế bào tủy máu (%) làm các biến. Công thức như sau:
RR = {0.0116 (tuổi-43.4) +0.0345 (lách-7.51) +0.188 [(số lượng tiểu cầu / 700) 2-O.563] +0.087 (ngũ cốc thô-2.10)}
RR <0.8 là rủi ro thấp, RR <0 8 = “” 1 = “” 2 = “” rr = “”> 1.2 là rủi ro cao. Một số dữ liệu chỉ ra rằng thời gian sống trung bình là 60 tháng ở nhóm nguy cơ thấp, 46 tháng ở nhóm nguy cơ trung bình và 32 tháng ở nhóm nguy cơ cao. Nhưng đối với bệnh nhân đang điều trị IFN, kết quả phán đoán của công thức này là không chắc chắn, và đáp ứng với điều trị IFN là một yếu tố quan trọng ảnh hưởng đến tiên lượng.
1. Ăn nhiều đồ có hàm lượng protein cao là do bệnh bạch cầu là do thay đổi bệnh lý trong tế bào máu, lượng protein tiêu thụ trong cơ thể của những bệnh nhân như vậy lớn hơn nhiều so với người bình thường, chỉ bằng cách bổ sung protein chất lượng cao thì các mô mới có thể duy trì được. Chức năng của cơ quan.
2. Ăn nhiều thực phẩm giàu chất sắt. Theo số liệu lâm sàng, 70-90% bệnh nhân có khối u ác tính có mức độ thiếu vitamin khác nhau , vì vậy nên ăn nhiều thực phẩm giàu chất sắt.
3. Điều chỉnh chế độ ăn uống theo tình trạng bệnh. Nó cũng rất quan trọng, bởi vì bệnh nhân bệnh có thể, nếu bệnh nhân dẫn đến thực phẩm kém hài lòng, khó tiêu thời gian
, có thể được cung cấp thực phẩm bán lỏng hoặc mềm, chẳng hạn như diethyl gạo, cháo đến hết gan, sữa trứng hấp, sữa chua, đậu hũ Nao, Xiaolong Baozi, v.v.
4. Ăn nhiều bữa nhỏ và thường xuyên, dễ tiêu hóa. Do bệnh nhân ung thư máu vốn đã khá yếu, cộng với tác dụng phụ của hóa trị và các phương pháp điều trị khác gây ra các triệu chứng như buồn nôn , nôn , chướng bụng , tiêu chảy nên lúc này bạn có thể chia thành nhiều bữa nhỏ và nhiều bữa hơn.