U nguyên bào hạt của âm hộ là gì? Tổng quan về bệnh
27 Tháng Một, 2021Contents Tổng quan về u nguyên bào hạt của âm hộ Khối u tế bào hạt cơ âm hộ...
Tổng quan về bệnh đa u tủy ở người già
Đa u tủy là một khối u ác tính được đặc trưng bởi sự tăng sinh không kiểm soát của các tế bào huyết tương vô tính . Sự xâm nhập tế bào huyết tương tăng sinh và các sản phẩm của nó (protein M, yếu tố hoại tử khối u, yếu tố tế bào huyết tương, v.v.) gây ra một loạt rối loạn chức năng cơ quan .

Contents
Căn nguyên của bệnh đa u tủy vẫn chưa rõ ràng. Các yếu tố nguy cơ có thể xảy ra bao gồm bức xạ ion hóa và sử dụng một số hóa chất, chẳng hạn như thuốc trừ sâu và thuốc diệt cỏ. Các nghiên cứu dịch tễ học đã phát hiện ra rằng bức xạ ion hóa là yếu tố nguy cơ được chứng minh rõ ràng nhất đối với MM, và các proto-oncogenes đặc biệt trên DNA và DNA có thể là mục tiêu chính của bức xạ ion hóa gây ung thư. Trong số những người sống sót sau vụ đánh bom nguyên tử, tỷ lệ mắc bệnh MM tăng lên sau khi ủ bệnh lâu dài, trong khi tỷ lệ mắc bệnh MM ở các bác sĩ X quang liên quan đến việc phơi nhiễm liều thấp trong thời gian dài, và nguy cơ mắc bệnh MM tăng gấp đôi so với dân số bình thường.
Các hóa chất như thuốc trừ sâu, benzen và các dung môi hữu cơ khác cũng liên quan đến sự khởi phát của MM. Hút thuốc và uống rượu hiện được coi là không liên quan đến sự khởi phát của MM.
Đã có báo cáo về MM ở các cặp song sinh và gia đình, nhưng không có bằng chứng nào chứng minh MM. Nó là một bệnh di truyền. Nhiều nghiên cứu đã tập trung vào HLA, bất thường nhiễm sắc thể , ung thư và những thay đổi môi trường liên quan đến MM. Một số nghiên cứu đã chỉ ra rằng HLA-B5 và một số kháng nguyên của HLA-C, chẳng hạn như HLA-CS và C2, cũng có thể liên quan đến MM. Về bất thường nhiễm sắc thể, các bất thường 14q + đặc hiệu hơn chiếm khoảng 32% các bệnh MM, các bất thường nhiễm sắc thể khác là không đặc hiệu. Ngoài ra, sự kích hoạt các gen sinh ung thư như N-ras và c-myc, và sự khiếm khuyết hoặc mất đi của các gen ức chế khối u như Rb và P53 có mối quan hệ nhất định với sự khởi phát của MM, đặc biệt là gen bcl-2 chống lại quá trình chết trong những năm gần đây. Nghiên cứu đã hiểu thêm về cơ chế bệnh sinh của MM.
Kích thích kháng nguyên mãn tính của hệ thống miễn dịch, chẳng hạn như nhiễm trùng do vi khuẩn và vi rút, có thể đóng một vai trò quan trọng trong cơ chế bệnh sinh của MM, nhưng kết quả của các nghiên cứu khác nhau không nhất quán và cần có các nghiên cứu dịch tễ học sâu hơn. MM cũng đã được báo cáo trong các nhóm nguy cơ cao bị AIDS, nhưng mối quan hệ giữa hai bệnh này là không rõ ràng.
Các nghiên cứu gần đây đã chỉ ra rằng khoảng 80% bệnh nhân có quần thể tế bào u tủy dị bội biểu hiện kháng nguyên bệnh bạch cầu nguyên bào lympho cấp tính phổ biến tiền B (CMLLA). Ruiz Angulles báo cáo 2 trường hợp đa tế bào CALLA tủy xương dương tính biểu hiện giai đoạn sớm đến muộn. Các kháng nguyên liên quan đến tế bào B, chẳng hạn như HL-A-DR, CD20, CD21. Và globulin miễn dịch bề mặt OKT10; sử dụng mẫu tủy xương trực tiếp và mẫu tủy xương nuôi cấy, người ta thấy rằng quần thể tế bào khối u ác tính tiền B của bệnh nhân u tủy biểu hiện tế bào chất cùng nhau. CMLLA, deoxynucleotide transferase tận cùng (TDT) và kháng nguyên tế bào huyết tương (PCA-2, PC-1), sự sắp xếp lại gen immunoglobulin chuỗi nặng và chuỗi nhẹ đã xác nhận tính đơn dòng của các tế bào này, và kiểu miễn dịch và Chỉ số đánh dấu kép cho thấy hoạt động tăng sinh của tế bào ác tính B đã vượt qua tế bào u tủy, có thể là tế bào gốc của u tủy. Kết quả trên cho thấy rằng tất cả các khối u huyết học đều có nguồn gốc từ một tế bào tiền thân của khối u chung.
Hiện nay người ta đã biết rằng nhiều yếu tố tăng trưởng có liên quan đến sự tăng trưởng và biệt hóa của tế bào B. Interleukin 4 (IL-4) kích thích giai đoạn nghỉ ngơi của tế bào B để tổng hợp DNA, IL-5 thúc đẩy tăng sinh tế bào và IL-6 kích thích tế bào B cuối cùng biệt hóa và trưởng thành. Tế bào huyết tương tiết ra globulin miễn dịch, IL-6 là yếu tố tăng trưởng quan trọng nhất đối với tế bào u tủy. Ở những bệnh nhân tiến triển, nồng độ IL-6 tăng lên và hàm lượng protein phản ứng C được điều chỉnh bởi IL-6, vì vậy nó có thể phản ánh gián tiếp Lượng IL-6 đơn giản và dễ quan sát.
Các yếu tố tăng trưởng khác ảnh hưởng đến tế bào u tủy thông qua con đường IL-6, chẳng hạn như yếu tố kích thích thuộc địa đại thực bào hạt (GM-CSF) để tăng phản ứng của tế bào khối u với IL-6, do đó làm tăng tốc độ tăng sinh, IL-1α, IL-1β Và yếu tố hoại tử khối u (TNF) có thể khiến các tế bào u tủy tiết ra IL-6 và kích thích sự phát triển của các tế bào u tủy. Yếu tố có thể ức chế tế bào u tủy là gamma interferon.
Tổn thương tiêu xương là một biểu hiện quan trọng của bệnh này, hiện nay được coi là u tủy Tổn thương u tủy không phải do u sưng thâm nhiễm tế bào mà do tế bào u tiết ra yếu tố kích hoạt hủy cốt bào (osteoclast activation factor; OAF) nên hủy cốt bào. Kích hoạt, kích thích tiêu xương cục bộ gần ổ thâm nhiễm của u tủy, đồng thời ức chế hoạt động tạo xương Hoạt động của OAF qua trung gian IL-1, lymphotoxin và TNF. Corticosteroid hoặc gamma interferon có thể ngăn chặn việc sản xuất các cytokine này.
Nguyên nhân của bệnh thận rất toàn diện, đó là tăng calci huyết , xâm nhập trực tiếp vào tế bào khối u, chuỗi nhẹ tự do và các thành phần protein khác gây ra amyloidosis ở thận, tăng sản xuất acid uric , kết tủa tinh thể acid uric trong kẽ , một lượng lớn chuỗi nhẹ và acid uric Nó có thể làm tắc nghẽn lòng ống thận, dẫn đến teo nephron tắc nghẽn; chuỗi ánh sáng cũng có thể trực tiếp làm tổn thương tế bào biểu mô ống thận và ảnh hưởng đến chức năng tập trung, dẫn đến tăng mất axit amin, đường, phốt pho, kali và các chất điện giải khác, tức là hội chứng Fanconi ở người lớn. Các trường hợp cá biệt có thể liên quan đến hội chứng thận hư Trong số nhiều yếu tố trên, tăng calci huyết và tổn thương chuỗi nhẹ ở ống thận là quan trọng nhất.

Các triệu chứng thường gặp: protein niệu, đau ngực, thiếu máu, đau xương, đau xương sườn, đau nhức, suy giảm miễn dịch, tê liệt
1. Đau xương là triệu chứng phổ biến nhất của bệnh này, với tỷ lệ mắc bệnh từ 70% đến 80%. Đau cao nhất ở lưng và xương sườn , có thể trầm trọng hơn khi hoạt động. Đau hoặc đau dai dẳng tại chỗ có thể là dấu hiệu của bệnh lý gãy xương và tiêu xương. Tổn thương thường gặp ở đốt sống, xương sọ, xương sườn, xương đòn, xương chậu và xương chậu, biểu hiện trên Xquang là tổn thương nhiều xuyên thấu, loãng xương và gãy xương bệnh lý.
Sự phá hủy xương của bệnh này hiếm khi đi kèm với sự hình thành xương mới, do đó, tỷ lệ phát hiện của xạ hình xương bằng hạt nhân phóng xạ thấp. Nếu có các triệu chứng đau nhức xương nhưng không có bất thường thì có thể chụp X-quang, CT hoặc cộng hưởng từ để giúp nâng cao tỷ lệ phát hiện. Bệnh lý xương có thể gây tăng calci huyết . U tủy có thể phình ra tại chỗ và tạo thành khối khi thâm nhiễm xương rõ ràng.
2. Suy giảm miễn dịch Tỷ lệ nhiễm bệnh này đã tăng lên đáng kể, các vi khuẩn gây bệnh thường gặp bao gồm phế cầu, tụ cầu, Escherichia coli và Haemophilus influenzae. Cơ chế suy giảm miễn dịch có nhiều mặt, chẳng hạn như giảm sản xuất kháng thể, giảm lysosome của bạch cầu hạt, di chuyển của bạch cầu hạt thấp hơn bình thường và chức năng bổ thể bất thường. Ngoài ra, mặc dù chức năng tế bào T bình thường ở một số bệnh nhân, các tập con tế bào CD4 + bị giảm và CD4 Tỷ lệ / CD8 giảm. Nhiễm trùng có thể đi kèm với tăng protein phản ứng C (IL-6 tăng cao), gây tăng sinh tế bào khối u và thúc đẩy bệnh tiến triển. Do đó, nhiễm trùng là nguyên nhân chính gây tử vong do bệnh này.
Nhiễm vi-rút cũng gia tăng, và bệnh zona rất phổ biến.
3. 90% bệnh nhân bị tổn thương thận có thể có protein niệu , đặc trưng là không có tăng huyết áp , hầu như là chuỗi nhẹ và chỉ có một lượng nhỏ albumin. Tỷ lệ dương tính với protein niệu được phát hiện bằng điện di miễn dịch hoặc điện di cố định miễn dịch trong tuần này là 80%. Khoảng 50% bệnh nhân có nồng độ creatinin huyết thanh tăng cao khi được chẩn đoán, tại Thượng Hải, phân tích toàn diện 130 trường hợp đa u tủy , 86 trường hợp suy thận ở các mức độ khác nhau, chiếm 66,2%, 32 trường hợp suy thận mạn tính. Không đầy đủ . Tỷ lệ suy thận cấp tính là 1% đến 2%. Nó có thể xảy ra khi chức năng thận bình thường. Các yếu tố dễ mắc bao gồm mất nước, nhiễm trùng cấp tính, chọc dò tĩnh mạch, tăng calci huyết và sử dụng các thuốc độc với thận.
4. Globulin miễn dịch đơn dòng (M-protein) Điện di protein huyết thanh cho thấy đỉnh M chiếm khoảng 80%, đây có thể là bất thường sớm nhất được phát hiện, 10% cho thấy có hạ đường huyết, và 10% không có bất thường về điện di. Phân bố 440 trường hợp đa u tủy loại M-protein thu thập được từ một số bệnh viện trong nước trong 10 năm qua như sau: Loại IgG chiếm 49,3%, loại IgA chiếm 20,5%, loại chuỗi nhẹ (loại BJ) chiếm 17,5% và loại IgD chiếm 6,6. %, loại vô tính kép chiếm 1%, 3% bệnh nhân khác không phát hiện M-protein tại thời điểm chẩn đoán, 2,1% bệnh nhân còn lại không được hoàn thiện. Tỷ lệ dương tính của protein M được phát hiện qua điện di miễn dịch và mẫu nước tiểu cô đặc là 80%, tỷ lệ κ: λ là 2: 1 và 2/3 bệnh nhân có loại IgG và IgA có thể có protein niệu trong tuần này. Do các loại protein M khác nhau, các biểu hiện lâm sàng cũng khác nhau. Ví dụ, các protein M loại IgG và IgA có độ nhớt cao hơn, và hội chứng độ nhớt cao có thể xảy ra ở nồng độ cao; loại chuỗi nhẹ có diễn biến bệnh ngắn và tiên lượng xấu. Có nhiều bệnh nhân suy thận, tuổi khởi phát của u tủy IgD thấp hơn các loại khác, thường gặp ở độ tuổi 50, chuỗi nhẹ do λ chi phối, thời gian tồn tại ngắn, dễ kết hợp với u tế bào xương hoặc u ngoại tủy. Theo báo cáo, u tủy IgD của Trung Quốc cao hơn đáng kể so với các nước phương Tây (1% đến 3%).
5. 80% bệnh nhân thiếu máu và giảm tiểu cầu có thể kèm theo thiếu máu, thường là sắc tố tế bào dương tính, nhưng cũng có thể giảm tiểu cầu. Thiếu máu và giảm tiểu cầu là do sự thay thế của tủy xương bình thường bằng các tế bào khối u tăng sinh, nhưng cả hai không thể Tỷ lệ, sự tồn tại của các chất ức chế tạo máu cho đến nay vẫn chưa được xác nhận. Các nghiên cứu gần đây đã chỉ ra rằng mức độ erythropoietin ở bệnh nhân thiếu máu u tủy thấp đáng kể, dẫn đến sản xuất tế bào hồng cầu kém. Erythropoietin tái tổ hợp của người có hiệu quả trong điều trị, và giảm bạch cầu là cực kỳ hiếm; rối loạn đông máu có thể do chức năng tiểu cầu kém hoặc protein M và các yếu tố đông máu Do tương tác.
6. Các triệu chứng hệ thần kinh chỉ gặp ở một số ít bệnh nhân như liệt, đau rễ thần kinh, rối loạn đại tiện do chèn ép tủy sống; bệnh amyloidosis thâm nhiễm vào dây thần kinh ngoại biên và gây ra hội chứng ống cổ tay (carpal tunnel syndrome); độ nhớt cao gây nhức đầu, suy nhược, Suy giảm thị lực và bệnh võng mạc.
7. Khác nếu M-protein tạo thành cryoglobulin, hiện tượng Raynaud, rối loạn tuần hoàn và hoại thư có thể xảy ra. Tỷ lệ mắc bệnh amyloidosis ở nước ta chỉ khoảng 7%, biểu hiện là lưỡi khổng lồ, tim to, suy tim, rối loạn nhịp tim, suy thận. Các hạch bạch huyết hoặc gan lách rất hiếm.
8. Phân giai đoạn lâm sàng hiện đang áp dụng phương pháp phân giai đoạn do Durie & Salmon đề xuất năm 1975. Theo các yếu tố khác nhau liên quan đến tiên lượng (hemoglobin, canxi, lượng protein M và sự tham gia của xương) trước khi điều trị, mức độ gánh nặng khối u toàn thân được ước tính: tải trọng thấp ( Giai đoạn I): <0 6 = “” 1012 = “” m2 = “” 0 = “” 6 = “” 1 = “” 2 = “” 1012 = “” m2 = “”> 1,2 × 1012 ô / m2. Theo chức năng thận, mỗi pha được chia thành: “A” creatinin huyết thanh <177 mol = “” l = “” 2mg = “” dl = “” b = “”> 177µmol / L (2mg / dl). Thời gian sống trung bình của giai đoạn Ⅰ> 60 tháng, thời gian sống trung bình của giai đoạn Ⅱ và Ⅲ tương ứng là 43 tháng và 23 tháng. Bệnh nhân mắc IA thường không cần điều trị và cần được theo dõi chặt chẽ để xác định xem họ có phải là u tủy tiến triển hay không. Có thể dựa vào các triệu chứng lâm sàng rõ ràng và sự tăng dần của protein M và sự xuất hiện hoặc tăng của protein niệu trong tuần này.
9. Phân loại lâm sàng
(1) Loại tổng quát: thường được chia thành 5 loại: ① đơn độc; ② nhiều lông; ③ lan tỏa; ④ tróc vảy; ⑤ loại bệnh bạch cầu . Các loại khác nhau có thể được chuyển thành lẫn nhau, chẳng hạn như loại biệt lập có thể trở thành nhiều loại, và nhiều loại có thể tiến triển thành loại bệnh bạch cầu. Cái gọi là bệnh đa tủy xương trên lâm sàng chủ yếu thuộc loại 2.
(2) Theo phân loại globulin miễn dịch, có các loại sau:
① U tủy loại IgG phổ biến hơn, chiếm 50% đến 60%, thường kết hợp với nhiễm trùng do giảm đáng kể lượng immunoglobulin bình thường. Protein M trong huyết thanh có thể cao, khối u phát triển khá chậm và thời gian nhân đôi của tế bào khối u là 10,1 tháng. Hiếm gặp tăng calci huyết và tăng amyloidosis.
② U tủy IgA chiếm 25%, tăng calci huyết rõ ràng, đồng nhiễm ít gặp hơn các loại khác; kết hợp với bệnh amyloidosis, càng có nhiều cơ hội cho máu đông và xu hướng chảy máu bất thường; thời gian nhân đôi của tế bào khối u là 6,3 tháng và tiên lượng xấu.
U tủy ③IgD hiếm gặp, chỉ chiếm 1,5%. 60% trẻ hơn 60 tuổi vào thời điểm chẩn đoán; phổ biến bất thường, tăng calci huyết, tăng amyloidosis, thiếu máu nặng, tăng ure huyết thường gặp hơn; tổng lượng protein huyết tương thường không cao và hầu hết các trường hợp đều có protein niệu trong tuần này Cả hai đều và 90% bệnh nhân thuộc loại λ; tế bào u tủy biệt hóa kém, có hình dạng ác hơn và có nhiều khả năng phát triển bệnh bạch cầu tế bào huyết tương; thời gian sống sót ngắn, trung bình chỉ 9 tháng.
④ U tủy chuỗi nhẹ chiếm 20% số bệnh nhân: khối u phát triển nhanh nhất và thời gian nhân đôi của tế bào khối u là 3,4 tháng; 80% -100% có protein niệu trong tuần này, và hơn 60% có tổn thương xương và tăng calci huyết ; So với loại IgG hoặc IgA, có nhiều khả năng bị suy thận và bệnh amyloidosis, tiên lượng rất xấu.
⑤ U tủy IgE rất hiếm: biểu hiện thiếu máu rõ rệt, hồng cầu lắng cục, dễ biến chứng thành bệnh bạch cầu nguyên bào huyết tương, 2/5 bệnh nhân bị xơ cứng xương. Hoạt động của tế bào hủy xương được tăng cường, và có thể tăng phosphatase kiềm trong huyết thanh.
⑥ U tủy không bài tiết chiếm dưới 1%: không có protein M trong máu, không có protein tuần trong nước tiểu; hiếm gặp suy thận; các biểu hiện lâm sàng khác giống loại xuất tiết. Nếu các biểu hiện lâm sàng không điển hình, có thể dùng phương pháp hóa mô miễn dịch để biết sự có hay không có của immunoglobulin trong tế bào chất.
Tiêu chuẩn chẩn đoán: thâm nhiễm tế bào huyết tương tủy xương> 10% hoặc sinh thiết mô xác nhận u cơ, cộng với bất kỳ trường hợp nào sau đây: ① M-protein huyết thanh> 30g / L; ② M-protein phát hiện trong nước tiểu; ③ tổn thương xương. Di căn xương, bệnh mô liên kết, nhiễm trùng mãn tính hoặc ung thư hạch bạch huyết phải được loại trừ.
Một quan điểm mới về chẩn đoán bệnh này: chẩn đoán sớm bệnh đa u tủy rất khó và dễ chẩn đoán nhầm. Nó thường bị chẩn đoán nhầm thành bệnh chỉnh hình, bệnh thần kinh, bệnh thận,… Đa số bệnh nhân được chẩn đoán ở giai đoạn muộn, mất cơ hội điều trị sớm.
Nếu mệt mỏi không rõ nguyên nhân , thiếu máu, tốc độ lắng hồng cầu nhanh, đau lưng, loãng xương hoặc tổn thương xương hoặc gãy xương bệnh lý, bất thường globulin miễn dịch, tăng calci huyết, protein niệu trong tuần, hội chứng thận hư hoặc chức năng thận Tình trạng kém hiệu quả, nhiễm trùng tái phát và chưa chữa khỏi, bệnh thần kinh ngoại biên, hội chứng ống cổ tay, gan to và cứng, và suy tim sung huyết khó chữa , v.v. đều nên được xem xét càng tốt.
Các hạng mục kiểm tra: phim chụp xương khớp chân tay, hình ảnh máu, kiểm tra tủy xương, globulin bất thường
1. Thiếu máu ngoại vi nói chung là trung bình, tế bào bình thường, loại sắc tố bình thường, kích thước hồng cầu nhìn thấy được. Có thể có một lượng nhỏ ấu trùng và hồng cầu non trong máu. Bạch cầu và tiểu cầu thường bình thường trong giai đoạn đầu, tế bào lympho và bạch cầu ái toan tăng nhẹ. Vào cuối giai đoạn, thường có pancytopenia , nhiều dòng xâm nhập tủy xương và ức chế các loại thuốc hóa trị. Do sự gia tăng đáng kể của globulin huyết tương, các tế bào hồng cầu trên vết phết thường sắp xếp theo hình đồng tiền. Tốc độ lắng của hồng cầu tăng lên đáng kể và phương pháp Widman có thể đạt tới 100-150mm / h, điều này hiếm gặp ở các bệnh khác và gây khó khăn cho việc xác định số lượng hồng cầu và nhóm máu.
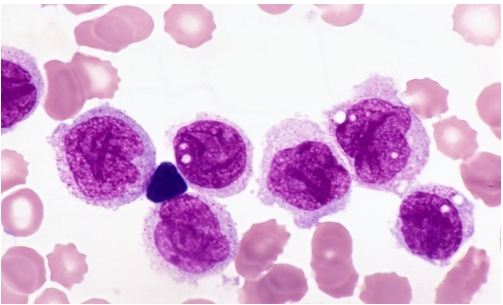
2. Chọc dò tủy có ý nghĩa chẩn đoán đặc hiệu. Trong giai đoạn đầu của bệnh, tổn thương tủy có thể phân bố khu trú và dạng nốt , do đó xét nghiệm âm tính không thể loại trừ bệnh, cần chọc nhiều lỗ. Vì xương ức dễ bị dính nên chọc dò xương ức là một bước chẩn đoán quan trọng khi cần thiết. Chọc thủng xương hoặc chụp X-quang có tổn thương có nhiều cơ hội dương tính hơn. Các tế bào nhân tủy xương hầu hết đang tăng sinh hoặc rõ ràng là đang hoạt động. Khi tế bào huyết tương trên 10%, kèm theo hình thái bất thường thì cần nghĩ đến khả năng bị u tủy. Mặc dù tế bào u tủy tương tự như tế bào plasma, nhưng kích thước và hình dạng của chúng khác nhau và sự trưởng thành của chúng cũng khác nhau. Đường kính nói chung là 15-30 µm, tròn đến elip; đường kính nhân có kích thước 5-7 µm, nghiêng sang một bên, từ 1 đến 2 nuclêôtit. Chất nhiễm sắc ở nhân mịn và lỏng hơn, hiếm khi xếp thành hình nách lá, và vòng bắt màu nhạt quanh nhân hầu như biến mất. Tế bào chất giàu hoặc trung bình và có màu bazơ, màu xanh đậm và bọt đục. Có thể có một lượng nhỏ các hạt màu xanh anilin, thể chứa hình cầu bạch cầu ái toan (cơ thể russell), không bào có kích thước khác nhau (như tế bào mulula, tế bào hình dâu hoặc tế bào Mott) hoặc các thể lớn hình que trong một số huyết tương. Nếu tế bào chất chứa đầy không bào lớn, màu xanh nhạt và có hiệu ứng ba chiều thì được gọi là tế bào nho. Tế bào plasma giống ngọn lửa và tế bào dự trữ (thesaurismosis) cũng có thể được nhìn thấy trong u tủy IgA, với nhiều tế bào chất và cấu trúc mạng, và có thể nhìn thấy 2 nhân, 3 nhân và một vài tế bào u tủy đa nhân. Tế bào u tủy phân bố không đều trong vết phết và thường tích tụ thành từng đống nhỏ.
Một số bệnh nhân gặp khó khăn trong việc chọc thủng tủy vì mô tủy có dạng thạch và có độ nhớt cao. Và bởi vì mô tủy xương được trộn lẫn với các khu vực có sự tăng sinh quá mức của các tế bào khối u và các tế bào tạo máu kém, rất khó để lấy được mô tủy xương nếu kim chọc thủng xảy ra ở khu vực tăng sinh kém.
Dưới kính hiển vi điện tử, người ta thấy rằng lưới nội chất thô của tế bào u tủy rất phong phú và đa dạng; các ribosome nói chung tiêu giảm và bộ máy Golgi được phát triển; các ti thể nói chung lớn hơn, số lượng tăng lên, các mấu cao và sưng lên. Tế bào chất của tế bào u tủy chứa nhiều thể biến đổi về hình thái và có màng bao bọc, trong nhân có các thể chứa được bao bọc bởi một lớp màng đơn, hoặc các bó sợi hình que xếp song song, có thể là nơi tích tụ các protein dự trữ.
3. Globulin bất thường
(1) Tăng globulin huyết và xuất hiện protein M: Khoảng 95% bệnh nhân, tổng lượng protein huyết thanh vượt quá bình thường, tăng globulin, albumin bình thường hoặc giảm, và tỷ lệ trắng / globulin đảo ngược. Một mẫu điện di bất thường có thể được nhìn thấy trên giấy hoặc điện di trên màng xenluloza axetat, cụ thể là M globulin, chủ yếu là vùng globulin miễn dịch có đỉnh đơn với sự bắt màu dày đặc và một số ít có đỉnh kép, có thể so sánh với tế bào người bình thường. Globulin miễn dịch được nhuộm nhẹ với một mẫu đồng nhất. Trong phân tích điện di trên giấy, tốc độ di chuyển của globulin đơn dòng IgG loại M có thể bằng tốc độ di chuyển của protein gamma, loại IgA đơn dòng nằm trong vùng beta, và các loại IgM và IgE đơn dòng nằm giữa vùng gamma và beta. Vì nồng độ IgD và IgE bình thường rất thấp, các globulin miễn dịch đơn dòng của chúng phải vượt quá nồng độ bình thường hơn 10 lần, và các đỉnh thực vật riêng lẻ di chuyển trong vùng γ hoặc β trong quá trình điện di. Ứng dụng của điện di miễn dịch, theo các thành phần khác nhau của M, có thể chia thành các loại sau: ① Loại IgG chiếm 50% đến 60%; ② Loại IgA chiếm 20% đến 25%; ③ Loại gelatin hoặc chuỗi nhẹ chiếm 20%; ④ Loại IgD chiếm 20% 1,5%, thường đi kèm với chuỗi nhẹ lambda; loại ⑤IgE và loại IgM rất hiếm, chỉ chiếm lần lượt 0,5% và <0,1%. Ngoài ra, vẫn có 1% bệnh nhân đa u tủy không tách được protein M trong huyết thanh, bệnh này được gọi là u tủy “nonsecretory”. Cryoglobulin vẫn tồn tại trong huyết thanh của một số ít bệnh nhân, kết tủa tự nhiên ở 4 ° C, nhưng lại tan ở 37 ° C.
(2) Protein của tuần (gel): Protein của tuần được tạo thành từ các chuỗi nhẹ dư thừa có trọng lượng phân tử nhỏ và có thể được bài tiết qua nước tiểu qua màng cầu thận. 50% đến 80% bệnh nhân u tủy có thể dương tính. Khi nước tiểu ấm dần đến 45-60 ° C, protein bắt đầu đông đặc trong tuần này, và sẽ tái hòa tan khi tiếp tục đun đến nhiệt độ sôi; nó sẽ kết tủa trở lại khi làm lạnh dưới 60 ° C. Điện di protein có thể hiển thị 1 đến 2 dải protein trong tuần ở vùng β hoặc giữa vùng β và γ. Protein đến từ máu trong tuần này. Do rò rỉ một lượng lớn trong nước tiểu, nên không thể phát hiện đỉnh trong điện di protein huyết thanh. Ở giai đoạn đầu của bệnh, tuần này protein thường xuất hiện không liên tục, đến giai đoạn muộn thì thường xuất hiện, do đó protein âm tính trong tuần này thì không thể loại trừ bệnh, cần kiểm tra nước tiểu nhiều lần. Tỷ lệ dương tính với xét nghiệm Peripherin. Ngoài ra, protein của tuần này không phải là duy nhất của bệnh này, chẳng hạn như bệnh bạch cầu mãn tính , di căn xương, đa sarcoma , bệnh đa hồng cầu , bệnh nhuyễn xương do tuổi già và u xơ cơ,… cũng có thể cho thấy phản ứng tích cực.
4. Khác do xương bị phá hủy nhiều, một lượng lớn canxi đi vào hệ tuần hoàn máu và xảy ra hiện tượng tăng canxi huyết . Phospho máu được đào thải chủ yếu qua thận nên khi chức năng thận bình thường thì phospho máu vẫn bình thường, nhưng ở người bệnh nặng, nhất là khi suy thận , phospho máu có thể tăng lên đáng kể. Vì u tủy chủ yếu là hủy xương mà không tạo xương mới, nên phosphatase kiềm trong huyết thanh hầu hết là bình thường hoặc tăng nhẹ, khác hẳn với di căn xương . Do sự phân hủy của các tế bào khối u và sự phá hủy nucleoprotein dẫn đến tăng acid uric máu , có thể gây sỏi acid uric trong trường hợp nặng. Khoảng 70% bệnh nhân là do sự liên kết và kết tủa của protein và canxi tự do trong ống thận và sự tích tụ của protein trong mao mạch cầu thận gây phá hủy nephron và suy giảm chức năng thận , có thể xảy ra protein niệu , nước tiểu dạng ống và tiểu máu . Nitơ urê huyết thanh và creatinin máu tăng. Cholesterol trong máu của một số bệnh nhân giảm đáng kể và có thể tăng sau khi điều trị.
Kiểm tra hình ảnh: Đa u tủy thường xảy ra ở cột sống, xương sườn, hộp sọ, xương ức và xương chậu và các bộ phận khác có chứa tủy đỏ. Đây là nơi tạo máu tích cực nhất ở người trưởng thành nên khả năng dính tủy là lớn nhất. Các xương dài, chẳng hạn như xương đùi và xương hầu, thường chỉ bị ảnh hưởng ở giai đoạn muộn. Hiếm gặp sự liên quan đến bên dưới đầu gối và khuỷu tay. Khoảng 10% xương của bệnh nhân có thể có kết quả dương tính với X-quang.
Các biểu hiện X-quang xương có thể có 3 loại sau:
1. Loãng xương lan tỏa Những bệnh nhân ban đầu có thể dễ dàng nhận thấy loãng xương lan tỏa ở cột sống, xương sườn và xương chậu. Cá nhân bị xơ cứng xương .
2. Tổn thương tiêu xương có thể được nhìn thấy với nhiều cạnh tròn, rõ ràng, chẳng hạn như khuyết tật xương hình mũi khoan hoặc hình chuột cắn, thường gặp ở xương sọ, xương chậu, cột sống, xương đùi, đầu xương và xương sườn.
3. Gãy xương bệnh lý thường nằm ở xương sườn và cột sống, cột sống có biểu hiện gãy do chèn ép

1. Di căn xương Tổn thương xương của bệnh đa u tủy được đặc trưng bởi sự phá hủy xương điển hình, thường gặp ở xương dẹt có hoạt động tạo máu tích cực, với hoạt tính tạo xương thấp. Ung thư di căn xương được đặc trưng bởi sự tiêu xương và phá hủy cấu trúc xương hỗn hợp tạo xương. Do đó, kết quả quét xương bằng hạt nhân phóng xạ cho thấy hầu hết đều nằm trong vùng tập trung phóng xạ; tế bào ung thư được tìm thấy bằng cách chọc hút hoặc sinh thiết tủy xương.
2. U tủy không triệu chứng (đa u tủy âm ỉ; SMM) M-protein> 30g / L, tế bào huyết tương tủy xương> 10%, không triệu chứng lâm sàng, không tổn thương xương, chỉ số marker 3H-TDR <0,4%, ổn định 5 năm Không phát triển.
3. Tế bào huyết tương phản ứng tăng được thấy trong viêm gan mãn tính, xơ gan, bệnh mô liên kết , bệnh truyền nhiễm mãn tính, viêm khớp dạng thấp , khối u ác tính, v.v … Tế bào huyết tương nói chung không vượt quá 10%, và hình thái của chúng tương đối trưởng thành, và có thể giảm sau khi loại bỏ nguyên nhân.
Các biến chứng bao gồm thiếu máu , nhiễm trùng, tăng calci huyết và suy thận.
Suy thận cấp là tình trạng mất chức năng bài tiết của cả hai thận trong thời gian ngắn do các bệnh khác nhau, gọi là suy thận cấp. Suy thận mạn là một hội chứng toàn diện bao gồm một nhóm các triệu chứng lâm sàng xảy ra khi bệnh thận mãn tính phát triển đến giai đoạn muộn do nhiều nguyên nhân khác nhau gây ra .
Tăng canxi huyết là hiện tượng tăng canxi máu, là tình trạng rối loạn chuyển hóa canxi. Khi một người trưởng thành lớn hơn canxi 2,75 mmol / L (11mg / dl ) là tăng canxi máu, bình thường là 2,2 ~ 2,75 mmol / L, các bệnh viện khác nhau giá trị tham chiếu của xét nghiệm vôi hóa máu có sự khác biệt nhỏ, có người canxi hơn 2,6mmol / l ( 10,5mg / l), giá trị bình thường là 2,0 ~ 2,55 mmol / L thì được xác định là tăng calci huyết.
Video tham khảo
Bệnh đa u tủy có tỷ lệ mắc cao ở người cao tuổi, nguyên nhân cụ thể chưa rõ ràng nhưng cũng có nhiều yếu tố nguy cơ cần phòng ngừa. Để giảm tỷ lệ mắc bệnh.
1. Bức xạ ion hóa là yếu tố nguy cơ quan trọng nhất. Ví dụ: Gần một phần ba số người sống sót sau vụ ném bom nguyên tử ở Hiroshima, Nhật Bản sau đó đã chết vì bệnh đa u tủy. Các cơ sở hạt nhân và một số vật liệu phóng xạ cần được bảo vệ chặt chẽ để tránh rò rỉ,
2. Yếu tố môi trường Các khí có hại trong khí quyển, môi trường sống và làm việc tiếp xúc với benzen và các dung môi hữu cơ đều là những yếu tố nguy cơ cao mắc bệnh này.
3. Một số kích thích viêm mãn tính có thể gây ra sự tăng sinh, biến đổi hoặc đột biến của tế bào lympho B, dẫn đến bệnh tật. Vì vậy, cần chủ động kiểm soát tình trạng nhiễm trùng, nâng cao khả năng miễn dịch của cơ thể, loại bỏ kịp thời kháng nguyên ngoại lai.
Xem thêm bài viết:
Các triệu chứng của bệnh bạch cầu myelomonocytic là gì? Thông tin chung
Bệnh bạch cầu tăng bạch cầu ái toan gây ra như thế nào? 2 Phương pháp điều trị
1. Khoảng 90% bệnh nhân điều trị thông thường cần điều trị tích cực, và 10% có đặc điểm là bệnh diễn biến chậm, không tiến triển sau nhiều năm và không cần điều trị ngay. Điều trị bao gồm hai khía cạnh, một là liệu pháp hỗ trợ và hai là hóa trị liệu toàn thân.
(1) điều trị hỗ trợ: bệnh hoạt động nên uống nước, 2 ~ 3L mỗi ngày, giữ nước tiểu> 1500ml / ngày, bài tiết theo chuỗi nhẹ, canxi, acid uric, có tăng calci huyết nên điều trị cấp cứu, sẵn tuyến thượng thận. Corticosteroid và truyền tĩnh mạch nước muối thông thường có thể thúc đẩy đào thải canxi. Hóa trị hiệu quả cũng có thể làm giảm nồng độ canxi huyết thanh. Nếu các phương pháp trên không có hiệu quả, hãy sử dụng phosphin xương, calcitonin và gali nitrat. Trong quá trình hóa trị, allopurinol 300mg / ngày được sử dụng để điều trị tăng acid uric máu .
Thiếu máu có thể được điều chỉnh bằng cách truyền khối hồng cầu đóng gói và kết hợp sử dụng nội tiết tố nam khi thích hợp. Có thể bổ sung sắt, axit folic hoặc vitamin B12 tùy theo tình trạng bệnh, nhưng hiệu quả chữa bệnh còn hạn chế. Những người có lượng erythropoietin thấp có thể điều trị bằng erythropoietin, có tác dụng trong hóa trị Trong trường hợp hemoglobin có thể tăng tương ứng.
Trao đổi huyết tương được sử dụng cho hội chứng tăng nhớt hoặc suy thận cấp . Chức năng thận được cải thiện do giảm M-protein. Lọc máu mãn tính nên được bắt đầu sau khi có đáp ứng hóa trị. Kiểm soát tích cực nhiễm trùng là điều cần thiết, vì nhiễm trùng là nguyên nhân chính gây tử vong ở bệnh nhân u tủy. Những bệnh nhân có triệu chứng thần kinh chi dưới, đau lưng dữ dội , rối loạn đại tiện cần được chụp tủy cấp cứu và chụp cộng hưởng từ để xác định chẩn đoán, nếu liệt có thể chẩn đoán kịp thời, xạ trị sớm , các triệu chứng thần kinh có thể hồi phục.
(2) Hóa trị toàn thân: Hóa trị được yêu cầu cho tất cả bệnh nhân ở giai đoạn Ⅱ, Ⅲ hoặc giai đoạn Ⅰ có protein niệu trong tuần . Phác đồ hóa trị tiêu chuẩn là sử dụng chất alkyl hóa Oxfen Arsine (Melphalan) cộng với prednisone (prednisone) (phác đồ MP), dùng thuốc trong 4 đến 7 ngày, ngắt quãng trong 4 đến 6 tuần. Liều lượng thông thường như sau: Oxyphenarsine (melphalan) 8mg / (m2 · d); prednisone (prednisone) 25mg / (m2 · d), liều lượng nên được điều chỉnh theo sự dung nạp của tủy xương cá nhân. Lượng protein M trong huyết thanh và (hoặc) nước tiểu có thể được sử dụng làm chỉ số đo gánh nặng khối u . Giảm 50% lượng protein M có hiệu quả và bệnh thuyên giảm hoàn toàn dựa trên sự biến mất của M-protein và sự trở lại của tủy xương; tỷ lệ hiệu quả của chương trình này là 50% -60%. Bệnh thuyên giảm hoàn toàn chiếm 3% và việc chữa khỏi là cực kỳ hiếm. Các nghiên cứu gần đây đã chỉ ra rằng với điều trị MP, thời gian sống sót có liên quan đến liều prednisone (prednisone), và liều prednisone (prednisone) lớn hơn có thể kéo dài đáng kể. Cả đời. Việc đánh giá khả năng tiêu diệt tế bào khối u dựa trên việc phát hiện protein M trong huyết thanh. Protein M huyết thanh thường giảm 3 tháng sau khi điều trị, do đó, máu, nước tiểu và tủy xương phải được đánh giá đầy đủ sau 3 tháng. Nếu không có M-protein trong huyết thanh hoặc nước tiểu giảm, cần xem xét điều trị khắc phục. Những người thuyên giảm bằng hóa trị liệu, đau xương , Cải thiện tình trạng tăng calci huyết, thiếu máu, mệt mỏi , giảm nhiễm trùng. Quá trình điều trị thường là 1 năm, đối với những người đã đạt được mức giảm 75% tế bào khối u, hầu hết thời gian thuyên giảm có thể duy trì từ 2 đến 3 năm, sự tăng sinh của các tế bào khối u còn sót lại trong giai đoạn thuyên giảm sẽ dừng lại ở giai đoạn GO / G1 và không nhạy cảm với hóa trị liệu. Bằng cách theo dõi các chỉ số khác nhau, khoảng 80% bệnh nhân tái phát có thể thuyên giảm lần thứ hai.
Hóa trị phối hợp được đưa ra vào đầu những năm 1970, phác đồ M2 đã được các bác sĩ lâm sàng trong và ngoài nước áp dụng rộng rãi, với tỷ lệ hiệu quả là 87%. Goldie và các cộng sự đã đề xuất một chương trình chung VMCP / VBAP sử dụng luân phiên các phương thức hành động khác nhau. Hiện nay người ta tin rằng hóa trị liệu kết hợp tốt hơn MP với vai trò gây thuyên giảm, giúp cải thiện tỷ lệ thuyên giảm và giảm đáng kể số lượng tế bào kháng thuốc. Thật không may, không có sự kéo dài thời gian sống thêm nào được ghi nhận.
VAD là phương pháp điều trị tốt nhất cho bệnh đa u tủy tái phát và khó chữa , với tỷ lệ hiệu quả là 70%. Nó có thể có hiệu quả đối với những người bị kháng sơ cấp.
(3) Điều trị duy trì: Interferon α (IFN-α) có tác dụng ức chế sự tăng sinh tế bào và điều hòa sự biểu hiện của ung thư, tác dụng ức chế chủ yếu nhằm vào các tế bào khối u không theo chu kỳ (GO-G1). Nó cũng có thể làm tăng hoạt động của tế bào NK và giảm protein M. Tạo, giảm sự hình thành dòng và chỉ số ghi nhãn, liệu pháp duy trì hứa hẹn nhất hiện nay là sử dụng interferon alpha (IFN-α).
(4) Việc cấy ghép tủy đồng loại hay tự thân sau khi thuyên giảm vẫn còn nhiều tranh cãi, vì bệnh nhân mắc bệnh này đã lớn tuổi và không thể chịu đựng được các bệnh đi kèm nặng do ghép tủy. Ghép tủy tự thân an toàn hơn so với ghép tủy xương, nhưng hầu hết bệnh nhân vẫn có nhiều tế bào khối u hơn sau khi cảm ứng thuyên giảm, và tỷ lệ tái phát sau khi cấy ghép cao. Tóm lại, hiệu quả của việc ghép tủy cần tích lũy ca bệnh và theo dõi lâu dài.
(5) Xu hướng nghiên cứu các phương pháp điều trị bằng thuốc khác: IL-6 là yếu tố tăng trưởng quan trọng đối với tế bào u tủy. Klein và cộng sự đã áp dụng kháng thể kháng IL-6 cho những bệnh nhân không điều trị bằng thuốc đầu tay và đạt được bệnh ổn định tạm thời. Trong quá trình điều trị bằng kháng thể, tỷ lệ tế bào u tủy tham gia vào quá trình tổng hợp DNA đã giảm đáng kể. Mặc dù hiệu quả thấp và tồn tại trong thời gian ngắn, nhưng việc áp dụng cytokine có thể có trong tương lai Cơ sở điều trị của bệnh này.
Trong những năm gần đây, các nghiên cứu nước ngoài đã xác nhận rằng axit retinoic (axit retinoic) ức chế sự phát triển của tế bào u tủy thông qua cơ chế điều hòa âm tính của thụ thể IL-6. Trung tâm Ung thư Sloan-Kettering đã đánh giá axit retinoic (axit retinoic) trong thử nghiệm lâm sàng giai đoạn II của nó. ) Tác dụng của thuốc đơn và interferon alpha phối hợp, có thể thu được kết luận giống nhau, có thể tretinoin (acid retinoic) thích hợp cho bệnh nhân tăng nồng độ IL-6 huyết thanh.
(6) Thalidomide (thalidomide): Thalidomide (thalidomide) hiện được sử dụng như một chất ức chế miễn dịch để điều trị bệnh u tủy tái phát và khó chữa. Vào tháng 9 năm 1999, Larkin báo cáo kết quả của thử nghiệm lâm sàng giai đoạn III do Nhóm công tác về u tủy quốc tế công bố, liều lượng thalidomide (thalidomide) là 50-400 mg / ngày, và liệu trình điều trị ít nhất là 8 tuần. phản ứng. Cơ chế hoạt động có thể có các cơ chế sau:
① Ức chế sản xuất yếu tố hoại tử khối u TNF-α.
② Ức chế sản xuất cytokine trong tập hợp con tế bào Tb.
③ Ức chế sự hình thành sinh vật mới. Hiệu quả của thalidomide (thalidomide) ở bệnh nhân MM và kết quả của việc sử dụng kết hợp với hóa trị liệu cần được nghiên cứu thêm.
Nguyên tắc lựa chọn phác đồ hóa trị: Hầu hết bệnh nhân chủ trương nguy cơ thấp không cần sử dụng hóa trị liệu cường độ cao, bệnh nhân nguy cơ cao có tiên lượng xấu nên sử dụng hóa trị liệu kết hợp cường độ cao. Yếu tố tiên lượng là vô cùng quan trọng để xác định phương pháp và cường độ điều trị.
2. Phương án tốt nhất
(1) Đối với những bệnh nhân mới điều trị, kế hoạch M2 nên là kế hoạch đầu tiên: (xem chi tiết điều trị ở trang trước) Tỷ lệ hiệu quả và tỷ lệ thuyên giảm của kế hoạch này tương đối cao. Và có ít tác dụng phụ hơn. Người bệnh dễ chấp nhận. Bắt đầu đợt điều trị tiếp theo cách nhau 3 đến 4 tuần. 6 lần liên tiếp, thay đổi kế hoạch nếu điều kiện thay đổi.
(2) Bổ sung interferon alpha vào hóa trị liệu: Nó có thể ức chế sự tăng sinh của các tế bào huyết tương tủy xương bất thường và kéo dài thời gian thuyên giảm và thời gian sống sót. Năng lượng nhiễu có sẵn (nhập khẩu) hoặc interferon (trong nước). Mỗi lần 3 triệu U, 3 lần / tuần, tiêm dưới da. Hiệu quả chữa bệnh có thể được đánh giá sau khi điều trị trên 1 năm. Chương trình NP + 1FIV (chương trình chung a-2b) thường được sử dụng ở nước ngoài.
(3) Đối với bệnh nhân bị bệnh xương, như tổn thương xương , gãy xương bệnh lý , loãng xương , tăng calci huyết, v.v. Trong khi sử dụng hóa trị hiệu quả, kết hợp với các chế phẩm bisphosphonate. Bisphosphonates có thể ức chế tế bào hủy xương và ngăn chặn sự hình thành tế bào hủy xương. Thúc đẩy sự hấp thụ canxi và có tác dụng chống khối u trực tiếp. Nó cũng có tác dụng giảm đau xương đáng kể.
(4) Đối với u tủy tái phát và khó chữa, có thể sử dụng thalidomide (thalidomide) hoặc ghép tế bào gốc tạo máu toàn thể .
Thời gian sống trung bình của bệnh nhân đa u tủy tiến triển không được điều trị là 6 tháng. Rõ ràng là hóa trị có thể kéo dài đáng kể thời gian sống và cải thiện chất lượng cuộc sống. Một số lượng lớn các nghiên cứu đã được thực hiện về các yếu tố tiên lượng, và chắc chắn rằng phân loại lâm sàng, đánh máy miễn dịch, thiếu máu, suy thận, vv có liên quan đến tiên lượng. Các nghiên cứu gần đây đã chỉ ra rằng lượng β2 microglobulin huyết thanh là yếu tố tiên lượng đáng tin cậy nhất. Bệnh nhân có β2 microglobulin> 4μg / ml có thời gian sống thêm chỉ 12 tháng, <4 g = “” ml = “” 43 = “”> 3%, LDH> 300U / L, hình thái tế bào tủy xương là loại tế bào nguyên sinh chất, tế bào u tủy được phát hiện trong máu ngoại vi, và tăng nồng độ IL-6 (tăng protein phản ứng C) đều liên quan đến tiên lượng xấu.
Bệnh đa u tủy thường nên có một chế độ ăn nhạt và chọn thực phẩm có thể ức chế sự tăng sinh quá mức của tủy xương, chẳng hạn như tảo bẹ, rong biển, wakame, trai biển và hạnh nhân. Lựa chọn có triệu chứng các loại thực phẩm chống huyết khối, bổ máu, tăng cường xương và giảm các loại thực phẩm lách to , chẳng hạn như tảo bẹ, rong biển, wakame, trai biển, hạnh nhân, đào nhân, mận, trai, cá, tỏi tây, thực vật núi, sứa, mai rùa, thịt rùa , Mụ cắt, óc chó. Gan lợn, ong sữa, mè, rùa, chạch, lươn biển. Bỏ thuốc lá, rượu bia, và tránh chất béo, hương vị ngọt và đặc, các sản phẩm lạnh và cay. Để ngăn ngừa nguồn bệnh, hãy uống sữa một cách hợp lý. Những người bị suy thận cũng nên áp dụng chế độ ăn ít muối. Nếu có bệnh đa hồng cầu và tăng tiểu cầu cần thiết thì nên bổ sung đậu phộng, nho và các thực phẩm làm tăng chức năng đông máu.
Xem thêm: